Види патологічного болю. Патофізіологія болю при запаленні
Для цитування:Решетняк В.К., Кукушкін М.Л. Патофізіологія болю при запаленні//РМЗ. 2004. №22. С. 1239
Слово біль поєднує у собі два суперечливі поняття. З одного боку, по крилатого виразудавньоримських медиків: «біль – це сторожовий пес здоров'я», а з іншого боку біль поряд з корисною, сигнальною функцією, що попереджає організм про небезпеку, викликає ряд патологічних ефектів, таких як тяжке переживання, обмеження рухливості, порушення мікроциркуляції, зниження імунного захисту, дизрегуляція функцій органів та систем. Біль може призводити до вираженої дизрегуляційної патології та може стати причиною шоку та смерті [Кукушкін М.Л., Решетняк В.К., 2002]. Біль є найпоширенішою ознакою багатьох захворювань. Експерти ВООЗ вважають, що 90% усіх захворювань пов'язані з болем. Пацієнти з хронічним болем у п'ять разів частіше звертаються за медичною допомогою, Порівняно з іншими людьми у популяції. Невипадково перший розділ фундаментального 10-томного керівництва з внутрішніх хвороб, виданого за редакцією Т.Р. Харрісона (1993), присвячений опису патофізіологічних аспектів болю. Біль завжди суб'єктивний, і його сприйняття залежить від інтенсивності, характеру та локалізації ушкодження, від природи ушкоджуючого фактора, від обставин, за яких відбулося ушкодження, від психологічного стану людини, її індивідуального життєвого досвіду та соціального статусу. Біль прийнято поділяти на п'ять компонентів: 1. Перцептуальний компонент, що дозволяє визначити місце ушкодження. 2. Емоційно-афективний компонент, що формує неприємне психоемоційне переживання. 3. Вегетативний компонент, що відбиває рефлекторні зміни роботи внутрішніх органів і тонусу симпато-адреналової системи 4. Двигунний компонент, спрямований на усунення дії стимулів, що ушкоджують. 5. Когнітивний компонент, що формує суб'єктивне ставлення до болю, що випробовується в даний момент, на основі накопиченого досвіду [Вальдман А.В, Ігнатов Ю.Д., 1976]. Основними чинниками, які впливають сприйняття болю, являются: 1. Пол. 2. Вік. 3. Конституція. 4. Виховання. 5. Попередній досвід. 6. Настрій. 7. Очікування болю. 8. Страх. 9. Роса. 10. Національність [МелзакР., 1991]. Насамперед сприйняття болю залежить від статевої приналежності індивідуума. При пред'явленні однакових за інтенсивністю болючих подразників у жінок об'єктивний показник болю (розширення зіниці) виражений сильніше. При використанні позитронної емісійної томографії було виявлено, що у жінок під час болючого подразнення відзначається значно більш виражена активація структур мозку. Спеціальне дослідження, проведене на новонароджених, показало, що дівчата виявляють більш виражену мімічну реакцію у відповідь больове роздратування, ніж хлопчики. Вік також має важливе значення для сприйняття болю. Клінічні спостереження здебільшого свідчать, інтенсивність больового сприйняття знижується з віком. Наприклад, кількість випадків безболісних інфарктів збільшується у пацієнтів віком від 65 років, збільшується також кількість випадків безболевої виразки шлунка. Однак ці феномени можуть пояснюватись різними особливостями прояву патологічних процесів у літньому віці, а не зниженням больового сприйняття як такого. При моделюванні патологічного болю аплікацією капсаїцину на шкіру у молодих та людей похилого віку виникав біль та гіпералгезія однакової інтенсивності. Однак у людей похилого віку відзначався подовжений латентний період до початку больових відчуттів і до розвитку максимальної інтенсивності болю. У людей похилого віку відчуття болю і гіпералгезія тривають довше, ніж у молодих. Було зроблено висновок, що у людей похилого віку знижена пластичність ЦНС при тривалому больовому подразненні. У клінічних умовах це проявляється більш повільним відновленням та тривалою підвищеною больовою чутливістю після пошкодження тканин [Решетняк В.К., Кукушкін М.Л., 2003]. Відомо також, що етнічні групи, які проживають у північних регіонах планети, легше переносять біль порівняно з жителів півдня [Мелзак Р., 1981]. Як було зазначено вище, біль є багатокомпонентним феноменом і його сприйняття залежить від багатьох чинників. Тому дати чітке, всеосяжне визначення болю досить важко. Найбільш популярним визначенням прийнято вважати формулювання, запропоноване групою експертів Міжнародної Асоціації з вивчення болю: «Біль – це неприємне відчуттята емоційне переживання, пов'язане з реальним або потенційним ушкодженням тканин або описане у термінах такого ушкодження». Це свідчить про те, що відчуття болю може виникати не тільки при пошкодженні тканини або в умовах ризику пошкодження тканини, але навіть при відсутності будь-якого пошкодження. У разі визначальним механізмом виникнення болю є психоемоційний стан людини (наявність депресії, істерії чи психозу). Іншими словами, інтерпретація людиною больового відчуття, її емоційна реакція та поведінка можуть не корелювати з тяжкістю ушкодження. Біль може бути розділений: на соматичний поверхневий (у разі пошкодження шкірних покривів), соматичний глибокий (при пошкодженні кістково-м'язової системи) та вісцеральну. Біль може виникати при пошкодженні структур периферичної та/або центральної нервових систем, що беруть участь у проведенні та аналізі больових сигналів. Нейропатичним болем називають біль, що виникає при пошкодженні периферичних нервів, а при пошкодженні структур центральної нервової системи - центральним болем [Решетняк В.К., 1985]. Особливу групу складають психогенні болі, які виникають незалежно від соматичних, вісцеральних чи нейрональних ушкоджень та визначаються психологічними та соціальними факторами. За тимчасовими параметрами виділяють гострий та хронічний біль. Гострий біль - це новий, недавній біль, нерозривно пов'язаний з його пошкодженням і, як правило, є симптомом будь-якого захворювання. Такий біль зникає при усуненні пошкодження [Калюжний Л.В., 1984]. Хронічний біль часто набуває статусу самостійної хвороби, триває тривалий період часу і причина, що викликала цей біль у ряді випадків може не визначатися. Міжнародна асоціація з вивчення болю визначає її як «біль, який триває понад нормальний період загоєння». Головною відмінністю хронічного болю від гострого є не тимчасовий фактор, а якісно інші нейрофізіологічні, біохімічні, психологічні та клінічні співвідношення. Формування хронічного болю значно залежить від комплексу психологічних чинників. Хронічний біль є улюбленою маскою прихованої депресії. Тісний зв'язок депресії з хронічним болем пояснюється загальними біохімічними механізмами [Філатова Є.Г., Вейн А.М., 1999]. Сприйняття болю забезпечується складноорганізованою ноцицептивною системою, що включає особливу групу периферичних рецепторів і центральних нейронів, розташованих у багатьох структурах центральної нервової системи і реагують на шкідливий вплив. Ієрархічна, багаторівнева організація ноцицептивної системи відповідає нейропсихологічним уявленням про динамічну локалізацію мозкових функцій і відкидає уявлення про «больовий центр», як конкретну морфологічну структуру, видалення якої сприяло б усуненню больового синдрому. Дане твердження підтверджується численними клінічними спостереженнями, що свідчать про те, що нейрохірургічне руйнування будь-якої з ноцицептивних структур у хворих, які страждають на хронічні больові синдроми, приносить лише тимчасове полегшення. Больові синдроми, що виникають внаслідок активації ноцицептивних рецепторів при травмі, запаленні, ішемії, розтягуванні тканин, відносять до соматогенних больових синдромів. Клінічно соматогенні больові синдроми виявляються наявністю постійної болісності та/або підвищенням больової чутливості в зоні ушкодження або запалення. Пацієнти, як правило, легко локалізують такі болі, чітко визначають їх інтенсивність та характер. Згодом зона підвищеної больової чутливості може розширюватись і виходити за межі пошкоджених тканин. Ділянки з підвищеною больовою чутливістю до стимулів, що ушкоджують, називають зонами гіпералгезії. Виділяють первинну та вторинну гіпералгезію. Первинна гіпералгезія охоплює пошкоджені тканини, вторинна гіпералгезія локалізується поза зоною ушкодження. Психофізично області первинної шкірної гіпералгезії характеризуються зниженням больових порогів і больової толерантності до механічних і термічним стимулам, що ушкоджують. Зони вторинної гіпералгезії мають нормальний больовий поріг та знижену больову толерантність лише до механічних подразників. Патофізіологічною основою первинної гіпералгезії є сенситизація (підвищення чутливості) ноцицепторів - А-? і С-волокон до дії стимулів, що ушкоджують. Сенситизація ноцицепторів проявляється зниженням порога активації, розширенням їх рецептивних полів, збільшенням частоти і тривалості розрядів у нервових волокнах, що зумовлює посилення аферентного ноцицептивного потоку [ Wall P . D., Melzack R., 1994]. Екзогенне або ендогенне ушкодження запускає цілий каскад патофізіологічних процесів, що зачіпають всю ноцицептивну систему (від тканинних рецепторів до кіркових нейронів), а також низку інших регуляторних систем організму. Екзогенне або ендогенне ушкодження призводить до викиду вазонейроактивних речовин, що ведуть до розвитку запалення. Ці вазонейроактивні речовини або звані медіатори запалення викликають як типові прояви запалення, зокрема і виражену больову реакцію, а й підвищують чутливість ноцицепторів до подальшим подразненням. Розрізняють кілька типів медіаторів запалення. I. Плазмові медіатори запалення 1. Калікрінін-кінінова система: брадикінін, каллідін 2. Компоненти компліменту: С2-С4, С3а, С5 - анафілотоксини, С3в - опсонін, С5-С9 - комплекс мембранної атаки 3. Система гемостазу: (фактор Хагемана), тромбін, фібриноген, фібринопептиди, плазмін та ін. II. Клеточные медиаторы воспаления 1. Биогенные амины: гистамин, серотонин, катехоламины 2. Производные арахидоновой кислоты: - простагландины (ПГЕ1, ПГЕ2, ПГF2 ? , тромбоксан А2, простациклин I2), - лейкотриены (ЛТВ4, МРС (А) - медленно реагирующая субстанция анафилаксии ), - хемотаксичні ліпіди 3. Гранулоцитарні фактори: катіонні білки, нейтральні та кислі протеази, лізосомальні ферменти 4. Фактори хемотаксису: нейтрофільний хемотаксичний фактор, хемотаксичний фактор еозинофілів та ін.2. - гідроксильна група 6. Адгезивні молекули: селектини, інтегрини 7. Цитокіни: ІЛ-1, ІЛ-6, фактор некрозу пухлини, хемокіни, інтерферони, колонієстимулюючий фактор та ін. нейропептиди: субстанція Р, кальцитонін ген-споріднений пептид, нейрокінін А, глутамат, аспартат, норадреналін, ацетилхолін. В даний час виділяють понад 30 нейрохімічних сполук, що беруть участь у механізмах збудження та гальмування ноцицептивних нейронів у центральній нервовій системі. Серед численної групи нейромедіаторів, нейрогормонів і нейромодуляторів, що опосередковують проведення ноцицептивних сигналів, існують як прості молекули - збуджуючі амінокислоти - ВАК (глутамат, аспартат), так і складні високомолекулярні сполуки (субстанція Р, нейрокінін А та кальцитонін ген-. . ВАК відіграють важливу роль механізмах ноцицепции. Глутамат міститься більш ніж у половині нейронів дорзальних гангліїв та вивільняється під дією ноцицептивних імпульсів. ВАК взаємодіють із кількома підтипами глутаматних рецепторів. Це насамперед іонотропні рецептори: NMDA-рецептори (N-метил-D-аспартат) та АМРА-рецептори (?-аміно-3-гідрокси-5-метил-4- ізоксазол-пропіонової кислоти), а також металоболотропні глутаматні рецептори. При активації цих рецепторів відбувається інтенсивне надходження іонів Са 2+ у клітину та зміна її функціональної активності. Формується стійка гіперзбудливість нейронів та виникає гіпералгезія. Необхідно підкреслити, що сенситизація ноцицептивних нейронів, що виникла внаслідок пошкодження тканин, може кілька годин або днів зберігатися і після припинення надходження ноцицептивних імпульсів з периферії. Іншими словами, якщо вже відбулася гіперактивація ноцицептивних нейронів, то вона не потребує додаткового підживлення імпульсами з місця ушкодження. Довготривале підвищення збудливості ноцицептивних нейронів пов'язують з активацією їх генетичного апарату - експресією ранніх генів, що негайно реагують, таких як c-fos, c-jun, junB та інші. Зокрема, продемонстровано позитивну кореляцію між кількістю fos-позитивних нейронів та ступенем болю. У механізмах активації протоонкогенів важлива роль відводиться іон Са 2+ . При підвищенні концентрації іонів Са 2+ у цитозолі, внаслідок посиленого їх входу через регульовані NMDA-рецепторами Са-канали, відбувається експресія с-fos, с-jun, білкові продукти яких беруть участь у регуляції довготривалої збудливості мембрани клітини. Останнім часом важливе значення у механізмах сенситизації ноцицептивних нейронів надається оксид азоту (NO), який у мозку виконує роль нетипового внесинаптичного медіатора. Малі розміри та відсутність заряду дозволяють NO проникати через плазматичну мембрану та брати участь у міжклітинній передачі сигналу, функціонально з'єднуючи пост- та пресинаптичні нейрони. NO утворюється з L-аргініну в нейронах, що містять фермент NO-синтетазу. NO виділяється з клітин при NMDA-індукованому збудженні та взаємодіє з пресинаптичними терміналями С-аферентів, посилюючи викид з них збудливої амінокислоти глутамату та нейрокінінів [Кукушкін М.Л. та ін, 2002; Шуматов В.Б. та ін, 2002]. Оксид азоту грає ключову роль запальних процесах. Локальне введення інгібіторів NО синтази в суглоб ефективно блокує ноцицептивну передачу та запалення. Усе це свідчить, що оксид азоту утворюється у запалених суглобах [Lawand N. B. et al., 2000]. Кініни є одними з найпотужніших алгогенних модуляторів. Вони швидко утворюються при пошкодженні тканини та викликають більшість ефектів, що спостерігаються при запаленні: вазодилатацію, збільшення судинної проникності, екстравазацію плазми, міграцію клітин, біль та гіпералгезію. Вони активують С-волокна, що призводить до нейрогенного запалення за рахунок викиду з нервових терміналей субстанції Р, кальцитонін генетичного пептиду та інших нейромедіаторів. Прямий збуджуючий ефект брадикініну на чутливі нервові закінчення опосередковується B2-рецепторами і пов'язаний з активацією мембранної фосфоліпази С. Непряма збуджуюча дія брадикініну на закінчення нервових аферентів обумовлена його впливом на різні тканинні елементи, ендотеліальні клітини, фібробласти та фібробласти. утворення в них медіаторів запалення, які взаємодіючи з відповідними рецепторами на нервових закінченнях, активують мембранну аденілатциклазу. У свою чергу, аденілатциклаза та фосфоліпазу С стимулюють утворення ферментів, що фосфорилюють білки іонних каналів. Результатом фосфорилювання білків іонних каналів є зміна проникності мембрани для іонів, що відбивається на збудливості нервових закінчень та здатності генерувати нервові імпульси. Брадикінін, діючи через В2-рецептори, стимулює утворення арахідонової кислоти з подальшим утворенням простагландинів, простациклінів, тромбоксанів та лейкотрієнів. Ці речовини, що мають виражену самостійну алгогенну дію, у свою чергу, потенціюють здатність гістаміну, серотоніну і брадикініну сенситизувати нервові закінчення. Внаслідок цього з немієлінізованих С-аферентів посилюється викид тахікінінів (субстанції Р та нейрокініна А), які, збільшуючи судинну проникність, ще більше підвищують локальну концентрацію медіаторів запалення [Решетняк В.К., Кукушкін М.Л., 2001]. Застосування глюкокортикоїдів запобігає утворенню арахідонової кислоти за рахунок пригнічення активності фосфоліпази А2. У свою чергу, нестероїдні протизапальні препарати (НПЗП) перешкоджають утворенню циклічних ендопероксидів, зокрема простагландинів. Під загальною назвою НПЗП об'єднуються різні за хімічною будовою речовини, що надають інгібуючу дію на циклооксигеназу. Всі нестероїдні протизапальні засоби в тій чи іншій мірі мають протизапальний, жарознижувальний та аналгетичний ефект. На жаль, практично всі НПЗП при тривалому застосуванні мають виражене побічною дією. Вони викликають диспепсію, пептичні виразки та шлунково-кишкові кровотечі. Може виникати також незворотне зниження клубочкової фільтрації, що веде до інтерстиціального нефритута гострою ниркової недостатності. НПЗП надають негативну дію на мікроциркуляцію, можуть викликати бронхоспазм [Філатова Є.Г., Вейн А.М., 1999; Чигодова Н.В., 2001; Насонов Є.Л., 2001]. В даний час відомо, що існує два різновиди циклооксигеназ. Циклооксигеназа-1 (ЦОГ-1) утворюється за умов норми, а циклооксигеназа-2 (ЦОГ-2) утворюється у процесі запалення. В даний час розробка ефективних НПЗП спрямована на створення виборчих інгібіторівЦОГ-2, які на відміну від неселективних інгібіторів мають значно менш виражену побічну дію. Разом з тим є відомості про те, що препарати зі «збалансованою» інгібуючою активністю по відношенню до ЦОГ-1 і ЦОГ-2 можуть мати більш виражену протизапальну та аналгетичну активність порівняно зі специфічними інгібіторами ЦОГ-2 [Насонов Е.Л., 2001 ]. Поряд із розробкою препаратів, що інгібують ЦОГ-1 та ЦОГ-2, ведуться пошуки принципово нових аналгетичних препаратів. Передбачається, що за хронічне запаленнявідповідальні В1-рецептори. Антагоністи цих рецепторів значно знижують прояви запалення. Крім того брадикінін бере участь у виробленні діацилгліцеролу та активує протеїнкіназу С, що, у свою чергу, посилює сенситизацію нервових клітин. Протеїнкіназа С грає дуже важливу роль у ноцицепції, і зараз проводяться пошуки препаратів, здатних пригнічувати її активність [Calixto J . B. et al., 2000]. Крім синтезу та викиду медіаторів запалення, гіперзбудливості спинальних ноцицептивних нейронів та посилення аферентного потоку, що йде в центральні структури мозку, певну роль відіграє активність симпатичної нервової системи. Встановлено, що підвищення чутливості терміналей ноцицептивних аферентів при активації симпатичних постгангліонарних волокон опосередковується двома шляхами. По-перше, за рахунок підвищення судинної проникності в зоні ушкодження та збільшення концентрації медіаторів запалення (непрямий шлях) і, по-друге, за рахунок прямого впливу нейротрансмітерів симпатичної нервової системи – норадреналіну та адреналіну на? 2-адренорецептори, розташовані на мембрані ноцицепторів. При запаленні відбувається активація так званих «мовчазних» ноцицептивних нейронів, які без запалення не відповідають різного роду ноцицептивні подразнення. Поряд із посиленням аферентного ноцицептивного потоку при запаленні відзначається посилення низхідного контролю. Це відбувається внаслідок активації антиноцицептивної системи. Вона активується, коли больовий сигнал досягає антиноцицептивних структур стовбура мозку, таламуса та кори великих півкульмозку [Решетняк В.К., Кукушкін М.Л., 2001]. Активація навколоводопровідної сірої речовини та великого ядра шва викликає вивільнення ендорфінів та енкефалінів, які зв'язуються з рецепторами, запускаючи серію фізико-хімічних змін, що зменшують біль. Існують три основні типи опіатних рецепторів: µ -, ? - І? -Рецептори. Найбільша кількість використовуваних анальгетиків надають свою дію завдяки взаємодії з µ-рецепторами. Донедавна було прийнято вважати, що опіоїди діють виключно на нервову систему та викликають аналгетичний ефект за рахунок взаємодії з опіоїдними рецепторами, локалізованими в головному та спинному мозку. Однак опіатні рецептори та їх ліганди виявлені на імунних клітинах, у периферичних нервах , у запалених тканинах . В даний час відомо, що 70% рецепторів до ендорфіну та енкефалінів розташовані в пресинаптичній мембрані ноцицепторів і найчастіше больовий сигнал пригнічується (перед тим як досягти задніх рогів спинного мозку). Дінорфін активує? -рецептори та інгібує вставкові нейрони, що призводить до вивільнення ГАМК, яка викликає гіперполяризацію клітин заднього рогу та інгібує подальшу передачу сигналу [Ігнатов Ю.Д., Зайцев А.А., 2001]. Опіоїдні рецептори розташовуються в спинному мозку головним чином навколо терміналів С-волокон у I пластині дорзальних рогів. Вони синтезуються в тілах малих клітин дорзальних гангліїв і транспортуються проксимально та дистально за аксонами. Опіоїдні рецептори неактивні в незапалені тканини, після початку запалення ці рецептори активуються протягом декількох годин. Синтез опіатних рецепторів у нейронах гангліїв дорзальних рогів також збільшується при запаленні, але цей процес, включаючи час транспортування аксонами, становить кілька днів [Schafer M. et al., 1995]. У клінічних дослідженнях встановлено, що ін'єкція 1 мг морфіну в колінний суглоб після видалення меніска дає виражений тривалий аналгетичний ефект. Надалі було показано наявність опіатних рецепторів у запаленій синовіальній тканині. Слід зазначити, що здатність опіатів викликати місцевий аналгетичний ефект за її аплікації на тканини було описано ще XVIII столітті. Так, англійський лікар Хеберден (Heberden) в 1774 опублікував роботу, в якій описав позитивний ефект аплікації екстракту опію при лікуванні гемороїдальних болів. Показаний хороший аналгетичний ефект діаморфіну при його локальній аплікації на місця пролежнів та на малігнізовані ділянки шкіри [Back L. N. and Finlay I., 1995; Krainik M . and Zylicz Z., 1997], при видаленні зубів в умовах вираженого запалення навколишньої тканини. Антиноцицептивні ефекти (що виникають протягом декількох хвилин після аплікації опіоїдів) залежать передусім від блокади поширення потенціалів дії, а також від зменшення викиду збуджуючих медіаторів, зокрема субстанції Р з нервових закінчень. Морфін погано абсорбується через нормальну шкіру та добре всмоктується через запалену. Тому аплікація морфіну на шкіру дає лише локальний аналгетичний ефект і діє системно. Останніми роками дедалі більше авторів починають говорити про доцільність застосування збалансованої аналгезії, тобто. поєднане застосування НПЗП та опіатних анальгетиків, що дає можливість знизити дози і відповідно побічні ефектияк перших, так і других [Ігнатов Ю.Д., Зайцев А.А., 2001; Осипова Н.А., 1994; Філатова Є.Г., Вейн А.М., 1999; Насонов Є.Л., 2001]. Опіоїди дедалі частіше починають застосовуватися при артритичних болях [Ігнатов Ю.Д., Зайцев А.А., 2001]. Зокрема, на даний час із цією метою використовується болюсна форма трамадолу. Цей препарат є агоністом-антагоністом [Машковський М.Д., 1993], і тому ймовірність виникнення фізичної залежності при використанні адекватних доз невелика. Відомо, що опіоїди, що належать до групи агоністів-антагоністів, значно меншою мірою викликають фізичну залежність порівняно з істинними опіатами [Філатова Є.Г., Вейн А.М., 1999]. Існує думка, що опіоїди, що використовуються в коректних дозах, безпечніші, ніж традиційні НПЗЗ [Ігнатов Ю.Д., Зайцев А.А., 2001]. Одним із найважливіших факторів хронізації болю є приєднання депресії. На думку деяких авторів, при лікуванні хронічного болю необхідно завжди використовувати антидепресанти незалежно від її патогенезу [Філатова Є.Г., Вейн А.М., 1999]. Протибольовий ефект акнтідепресантів досягається за рахунок трьох механізмів. Перший – зменшення депресивної симптоматики. Другий - антидепресанти активують серотонічні та норадренергічні антиноцицептивні системи. Третій механізм полягає в тому, що амітриптилін та інші трициклічні антидепресанти діють як антагоністи NMDA-рецепторів та взаємодіють з ендогенною аденозиновою системою. Таким чином, у патогенезі больових синдромів, що виникають при запаленні, бере участь велика кількість різних нейрофізіологічних та нейрохімічних механізмів, які неминуче призводять до змін у психофізіологічному статусі пацієнта. Тому поряд із протизапальними та аналгетичними препаратами для проведення комплексної патогенетично обґрунтованої терапії, як правило, необхідно призначати й антидепресанти.
Література
1. Вальдман А.В., Ігнатов Ю.Д. Центральні механізми болю. - Л.: Нау-
ка, 1976. 191.
2. Внутрішні хвороби. У 10 книжках. Книга 1. Пер з анг. За ред. е.
Браунвальда, К.Дж. Іссельбахера, Р.Г. Петерсдорфа та ін - М.: Меді-
цина, 1993, 560.
3. Ігнатов Ю.Д., Зайцев А.А. Сучасні аспекти терапії болю: опі-
а ти. Якісна клінічна практика. 2001, 2, 2-13.
4. Калюжний Л.В. Фізіологічні механізмирегуляції больової чутливості
ності. М: Медицина, 1984, 215.
5. Кукушкін М.Л. Графова В.М., Смирнова В.І. та ін Роль оксиду азо-
та у механізмах розвитку больового синдрому // Анестезіол. і реані-
матол., 2002, 4, 4-6.
6. Кукушкін М.Л., Решетняк В.К. Дизрегуляційні механізми патології
чеського болю. У Кн: Дизрегуляційна патологія. (за ред. Г.Н. Кри-
Жановського) М.: Медицина, 2002. 616 -634.
7. Машковський М.Д. Лікарські засоби. 1993, М. Медицина, 763.
8. Мелзак Р. Загадка болю. Пров. з англ. М: Медицина, 1981, 231 с.
9. Насонов Є.Л. Аналгетичні ефекти нестероїдних протизапальних препаратів при захворюваннях опорно-рухового апарату: баланс ефективності та безпеки. Consilium medicum, 2001, 5, 209-215.
10. Осипова Н.А. Сучасні засади клінічного застосування аналгетиків центральної дії. Анест. та реаніматол. 1994, 4, 16-20.
11. Решетняк В.К. Нейрофізіологічні основи болю та рефлекторного
знеболення. Підсумки науки та техніки. ВІНІТИ. Фізіол. людини і жи-
отних, 1985. 29. 39-103.
12. Решетняк В.К., Кукушкін М.Л. Біль: фізіологічні та патофізіо-
логічні аспекти У Кн: Актуальні проблеми патофізіології (із-
ланні лекції). За ред. Б.Б. Мороз. М: Медицина, 2001, 354-389.
13. Решетняк В.К., Кукушкін М.Л. Вікові та статеві відмінності
Прийняття болю // Клінічна геронтологія, 2003, Т 9 №6, 34-38.
14. Філатова Є.Г., Вейн А.М. Фармакологія болю. Російський медичний
журнал, 1999, 9, 410-418.
15. Чичасова Н.В. Локальне застосування аналгетичних засобів при
захворюваннях суглобів та хребта. Consilium medicum, 2001, 5,
215-217.
16. Шуматов В.Б., Шуматова Т.А., Балашова Т.В. Вплив епідуральної
аналгезії морфіном на NO-утворюючу активність ноцицептивних нейронів спинальних гангліїв та спинного мозку. Анестезіол. і реаніму-
тол., 2002, 4, 6-8.
17. Back L.N., Finlay I. Analgesic effect of topical opioids on
painful skin ulcers. // J. Pain Symptom Manage, 1995, 10, 493.
18. Cabot PJ, Cramond T., Smith M.T. Quantitative autoradiography
of peripheral opioid binding sites in rat lung. Eur. J. Pharmacol.,
1996, 310, 47-53.
19. Calixto J.B., Cabrini D.A., Ferreria J.,Kinins in pain and
inflammation. Pain, 2000, 87, 1-5
20. Coderre T.J., Katz J., Vaccarino A.L., Melzack R. Contribution
of central neuroplasticity to pathological pain: review of clinical
and experimental evidence. Pain, 1993, 52, 259-285.
21. Dickenson A.H. Where and how do opioids act. Proceedings of the
7th World Congress on Pain, Progress in Pain Research and Management,
edited by G.F. Gebhart, D.L. Hammond та T.S. Jensen, IASP Press,
Seattle, 1994, 2, 525-552.
22. Dickenson A.H. pharmacology of pain transmission and control.
Pain, 1996. Refresher Course Syllabus (8th World
Congress on Pain), IASP Press, Seattle, WA, 1996, 113-121.
23. Hassan A.H.S., Ableitner A., Stein C., Herz A. inflamation of
the rat paw enhances axonal transport of opioid receptors in the sciatic
nerve і ускладнює свою невдачу в inflamed tissue.//
Neurosci.., 1993, 55, P.185-195.
24. Krainik M., Zylicz Z. Topical morphine для malignant cutaneouspain. Palliative. Med., 1997, 11, 325.
25. Krajnik M., Zylicz Z., Finlay I. та ін. Potential uses of topical
opioids в palliative care-report of 6 cases. Pain, 1999, 80,
121-125.
26. Lawand N.B., McNearney T., Wtstlund N. Amino acid release into
the knee joint: key role in nociception and inflammation, Pain, 2000,
86, 69-74.
27. Lawrence AJ, Joshi GP, Michalkiewicz A. et al. Evidence for
analgesia mediated by peripheral opioid receptors in inflamed synovial
tissue.// Eur. J. Clin. Pharmacol., 1992, 43, P. 351-355.
28. Likar R., Sittl R., Gragger K. та ін. Peripheral morphine analgesia
in dental surgery. Pain, 1998, 76, 145-150.
29. Likar R., Sittl R., Gragger K. та ін. Opiate receptors. Its
demonstration in nervous tissue.Science, 1973, 179, 1011-1014.
30. Przewlocki R., Hassan A.H.S., Lason W. et al. Gene expression
and localization of opioid peptides in immune cells of inflamed tissue:
функціональна роль в антиноципітації. Neurosci., 1992, 48,
491-500.
31. Ren K. Dubner R
в rats with persistent hindpaw inflammation. J. neurophysiol, 1996,
76, 3025-3037.
32. Schafer M., Imai Y., Uhl G.R., Stein C. Inflammation enhances
peripheral mu-opioid receptor-mediated analgesia, але не m-opioid
receptor transcription in dorsal root ganglia.// Eur. J. Pharmacol.,
1995, 279, 165-169.
33. Stein C., Comisel K., Haimerl E. та ін. Analgesic effect of
intraarticular morphine після arthroscopic knee surgery. // N. Engl.
Med., 1991; 325: p. 1123-1126.
34. Torebjork E., Nociceptor dynamics in humans, In: G.F. Gebhart,
D.L. Hammond та T.S. Jensen (Eds.), Proceedings of the 7th World
Congress on Pain. Progress in Pain Research and Management, IASP
Press, Seattle, WA, 1994, 2, pp. 277-284.
35. Wall P.D., Melzack R. (Eds) Textbook of pain, 3rd ed., Churchill
Livingstone, Edinbugh, 1994.
36. Wei F., Dubner R., Ren K. Nucleus reticularis gigantocellularis
і нуклеїс рапхе magnus в brain stem exert opposite effects on
behavioral hyperalgesia and spinal Fos protein expression after
Періферальна inflammation. Pain, 1999, 80, 127-141.
37. Wei R., Ren K., Dubner R. Inflammation-induced Fos protein
expression in the rat spinal cord is enhanced following dorsolateral
або ventrolateral funiculus lesions. Brain Res., 1998, 782,
116-141.
38. Wilcax G.L. IASP Refresher Courses on Pain Management, 1999,
573-591.
39. Willis W.D. Signal transduction mechanisms. Pain 1996 - An
Updated Review. Refresher Course Syllabus (8th World Congress on
Pain), IASP Press, Seattle, WA, 1996, 527-531.
40. Zimlichman R., Gefel D., Eliahou H. та ін. Expression of opioid
receptors під час heart ontogeny в normotensive and hypertensive
rats. // Circulation, 1996; 93: p. 1020–1025.
Слово біль поєднує у собі два суперечливі поняття. З одного боку, за крилатим висловом давньоримських медиків: «біль – це сторожовий пес здоров'я», а з іншого боку біль поряд з корисною, сигнальною функцією, що попереджає організм про небезпеку, викликає ряд патологічних ефектів, таких як тяжке переживання, обмеження рухливості, порушення мікроциркуляції, зниження імунного захисту, дизрегуляція функцій органів та систем. Біль може призводити до вираженої дизрегуляційної патології та може стати причиною шоку та смерті [Кукушкін М. Л., Решетняк В. К., 2002].
Біль є найпоширенішою ознакою багатьох захворювань. Експерти ВООЗ вважають, що 90% усіх захворювань пов'язані з болем. Пацієнти з хронічним болем у п'ять разів частіше звертаються за медичною допомогою, порівняно з іншими в популяції. Не випадково перший розділ фундаментального 10-томного посібника з внутрішніх хвороб, виданого за редакцією Т. Р. Харрісона (1993), присвячений опису патофізіологічних аспектів болю. Біль завжди суб'єктивний, і його сприйняття залежить від інтенсивності, характеру та локалізації ушкодження, від природи ушкоджуючого фактора, від обставин, за яких відбулося ушкодження, від психологічного стану людини, її індивідуального життєвого досвіду та соціального статусу.
Біль прийнято поділяти на п'ять компонентів:
- Перцептуальний компонент дозволяє визначити місце пошкодження.
- Емоційно-афективний компонент, що формує неприємне психоемоційне переживання.
- Вегетативний компонент, що відображає рефлекторні зміни роботи внутрішніх органів та тонусу симпато-адреналової системи.
- Двигунний компонент, спрямований на усунення дії стимулів, що ушкоджують.
- Когнітивний компонент, що формує суб'єктивне ставлення до болю на основі накопиченого досвіду [Вальдман А. В, Ігнатов Ю. Д., 1976].
Основними факторами, що впливають на сприйняття болю, є:
- Вік.
- Конституція.
- Виховання.
- Попередній досвід.
- Настрій.
- Очікування болю.
- Страх.
- Роса.
- Національність [Мелзак Р., 1991].
Насамперед сприйняття болю залежить від статевої приналежності індивідуума. При пред'явленні однакових за інтенсивністю болючих подразників у жінок об'єктивний показник болю (розширення зіниці) виражений сильніше. При використанні позитронної емісійної томографії було виявлено, що у жінок під час болючого подразнення відзначається значно більш виражена активація структур мозку. Спеціальне дослідження, проведене на новонароджених, показало, що дівчата виявляють більш виражену мімічну реакцію у відповідь больове роздратування, ніж хлопчики. Вік також має важливе значення для сприйняття болю. Клінічні спостереження здебільшого свідчать, інтенсивність больового сприйняття знижується з віком. Наприклад, кількість випадків безболісних інфарктів збільшується у пацієнтів віком від 65 років, збільшується також кількість випадків безболевої виразки шлунка. Однак ці феномени можуть пояснюватись різними особливостями прояву патологічних процесів у літньому віці, а не зниженням больового сприйняття як такого.
При моделюванні патологічного болю аплікацією капсаїцину на шкіру у молодих та людей похилого віку виникав біль та гіпералгезія однакової інтенсивності. Однак у людей похилого віку відзначався подовжений латентний період до початку больових відчуттів і до розвитку максимальної інтенсивності болю. У людей похилого віку відчуття болю і гіпералгезія тривають довше, ніж у молодих. Було зроблено висновок, що у людей похилого віку знижена пластичність ЦНС при тривалому больовому подразненні.
У клінічних умовах це проявляється більш повільним відновленням та тривалою підвищеною больовою чутливістю після пошкодження тканин [Решетняк В. К., Кукушкін М. Л., 2003]. Відомо також, що етнічні групи, що проживають у північних регіонах планети, легше переносять біль порівняно з жителів півдня [Мелзак Р., 1981]. Як було зазначено вище, біль є багатокомпонентним феноменом і його сприйняття залежить від багатьох чинників. Тому дати чітке, всеосяжне визначення болю досить важко. Найбільш популярним визначенням прийнято вважати формулювання, запропоноване групою експертів Міжнародної Асоціації з вивчення болю: «Біль — це неприємне відчуття та емоційне переживання, пов'язане з реальним чи потенційним ушкодженням тканин або описується у термінах такого ушкодження». Це свідчить про те, що відчуття болю може виникати не тільки при пошкодженні тканини або в умовах ризику пошкодження тканини, але навіть при відсутності будь-якого пошкодження.
В останньому випадку визначальним механізмом виникнення болює психоемоційний стан людини (наявність депресії, істерії чи психозу). Іншими словами, інтерпретація людиною больового відчуття, її емоційна реакція та поведінка можуть не корелювати з тяжкістю ушкодження. . Біль може бути розділений: на соматичний поверхневий (у разі пошкодження шкірних покривів), соматичний глибокий (при пошкодженні кістково-м'язової системи) та вісцеральний. Біль може виникати при пошкодженні структур периферичної та/або центральної нервових систем, що беруть участь у проведенні та аналізі больових сигналів. Нейропатичним болем називають біль, що виникає при пошкодженні периферичних нервів, а при пошкодженні структур центральної нервової системи - центральним болем [Решетняк Ст К., 1985]. Особливу групу складають психогенні болі, які виникають незалежно від соматичних, вісцеральних чи нейрональних ушкоджень та визначаються психологічними та соціальними факторами. За тимчасовими параметрами виділяють гострий та хронічний біль.
Гострий біль— це новий, недавній біль, нерозривно пов'язаний з його пошкодженням і, як правило, є симптомом будь-якого захворювання. Такий біль зникає при усуненні пошкодження [Калюжний Л. Ст, 1984].Хронічний більчасто набуває статусу самостійної хвороби, триває тривалий період часу і причина, що викликала цей біль у ряді випадків може не визначатися. Міжнародна асоціація з вивчення болю визначає її як «біль, який триває понад нормальний період загоєння». Головною відмінністю хронічного болю від гострого є не тимчасовий фактор, а якісно інші нейрофізіологічні, біохімічні, психологічні та клінічні співвідношення. Формування хронічного болю значно залежить від комплексу психологічних чинників. Хронічний біль є улюбленою маскою прихованої депресії. Тісний зв'язок депресії з хронічним болем пояснюється загальними біохімічними механізмами . Сприйняття болю забезпечується складноорганізованою ноцицептивною системою, що включає особливу групу периферичних рецепторів і центральних нейронів, розташованих у багатьох структурах центральної нервової системи і реагують на шкідливий вплив. Ієрархічна, багаторівнева організація ноцицептивної системи відповідає нейропсихологічним уявленням про динамічну локалізацію мозкових функцій і відкидає уявлення про «больовий центр», як конкретну морфологічну структуру, видалення якої сприяло б усуненню больового синдрому.
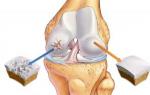
Дане твердження підтверджується численними клінічними спостереженнями, що свідчать про те, що нейрохірургічне руйнування будь-якої з ноцицептивних структур у хворих, які страждають на хронічні больові синдроми, приносить лише тимчасове полегшення. Больові синдроми, що виникають внаслідок активації ноцицептивних рецепторів при травмі, запаленні, ішемії, розтягуванні тканин, відносять до соматогенних больових синдромів. Клінічно соматогенні больові синдроми виявляються наявністю постійної болісності та/або підвищенням больової чутливості в зоні ушкодження або запалення. Пацієнти, як правило, легко локалізують такі болі, чітко визначають їх інтенсивність та характер. Згодом зона підвищеної больової чутливості може розширюватись і виходити за межі пошкоджених тканин. Ділянки з підвищеною больовою чутливістю до стимулів, що ушкоджують, називають зонами гіпералгезії.
Виділяють первинну та вторинну гіпералгезію. Первинна гіпералгезія охоплює пошкоджені тканини, вторинна гіпералгезія локалізується поза зоною ушкодження. Психофізично області первинної шкірної гіпералгезії характеризуються зниженням больових порогів і больової толерантності до механічних і термічним стимулам, що ушкоджують.
Зони вторинної гіпералгезії мають нормальний больовий поріг та знижену больову толерантність лише до механічних подразників. Патофізіологічною основою первинної гіпералгезії є сенситизація (підвищення чутливості) ноцицепторів - А-і С-волокон до дії стимулів, що пошкоджують. Сенситизація ноцицепторів проявляється зниженням порога їх активації, розширенням їх рецептивних полів, збільшенням частоти та тривалості розрядів у нервових волокнах, що призводить до посилення аферентного ноцицептивного потоку. [Wall P. D., Melzack R., 1994]. Екзогенне або ендогенне ушкодження запускає цілий каскад патофізіологічних процесів, що зачіпають всю ноцицептивну систему (від тканинних рецепторів до кіркових нейронів), а також низку інших регуляторних систем організму. Екзогенне або ендогенне ушкодження призводить до викиду вазонейроактивних речовин, що ведуть до розвитку запалення. Ці вазонейроактивні речовини або звані медіатори запалення викликають як типові прояви запалення, зокрема і виражену больову реакцію, а й підвищують чутливість ноцицепторів до подальшим подразненням. Розрізняють кілька типів медіаторів запалення.
I. Плазмові медіатори запалення
- Калікрінін-кінінова система: брадикінін, калідин
- Компоненти компліменту: С2-С4, С3а, С5 – анафілотоксини, С3в – опсонін, С5-С9 – комплекс мембранної атаки
- Система гемостазу та фібринолізу: XII фактор (фактор Хагемана), тромбін, фібриноген, фібринопептиди, плазмін та ін.
ІІ. Клітинні медіатори запалення
- Біогенні аміни: гістамін, серотонін, катехоламіни
- Похідні арахідонової кислоти: - простагландини (ПГЕ1, ПГЕ2, ПГF2?, тромбоксан А2, простациклін I2), - лейкотрієни (ЛТВ4, МРС (А) - повільно реагує субстанція анафілаксії), - хемотаксичні ліпіди
- Гранулоцитарні фактори: катіонні білки, нейтральні та кислі протеази, лізосомальні ферменти
- Фактори хемотаксису: нейтрофільний хемотаксичний фактор, хемотаксичний фактор еозинофілів та ін.
- Кисневі радикали: О2-супероксид, Н2О2, NO, ОН-гідроксильна група
- Адгезивні молекули: селектини, інтегрини
- Цитокіни: ІЛ-1, ІЛ-6, фактор некрозу пухлини, хемокіни, інтерферони, колонієстимулюючий фактор та ін.
- Нуклеотиди та нуклеозиди: АТФ, АДФ, аденозин
- Нейромедіатори та нейропептиди: субстанція Р, кальцитонін ген-споріднений пептид, нейрокінін А, глутамат, аспартат, норадреналін, ацетилхолін.
В даний час виділяють понад 30 нейрохімічних сполук, що беруть участь у механізмах збудження та гальмування ноцицептивних нейронів у центральній нервовій системі. Серед численної групи нейромедіаторів, нейрогормонів та нейромодуляторів, які опосередковують проведення ноцицептивних сигналів, існують як прості молекули. збуджуючі амінокислоти - ВАК(глутамат, аспартат), так і складні високомолекулярні сполуки (субстанція Р, нейрокінін А, кальцитонін ген-споріднений пептид та ін).
ВАК відіграють важливу роль механізмах ноцицепции. Глутамат міститься більш ніж у половині нейронів дорзальних гангліїв та вивільняється під дією ноцицептивних імпульсів. ВАК взаємодіють із кількома підтипами глутаматних рецепторів. Це насамперед іонотропні рецептори: NMDA-рецептори (N-метил-D-аспартат) та АМРА-рецептори (?-аміно-3-гідрокси-5-метил-4- ізоксазол-пропіонової кислоти), а також металоболотропні глутаматні рецептори .
При активації цих рецепторів відбувається інтенсивне надходження іонів Са 2+ у клітину та зміна її функціональної активності. Формується стійка гіперзбудливість нейронів та виникає гіпералгезія. Необхідно підкреслити, що сенситизація ноцицептивних нейронів, що виникла внаслідок пошкодження тканин, може кілька годин або днів зберігатися і після припинення надходження ноцицептивних імпульсів з периферії. Іншими словами, якщо вже відбулася гіперактивація ноцицептивних нейронів, то вона не потребує додаткового підживлення імпульсами з місця ушкодження. Довготривале підвищення збудливості ноцицептивних нейронів пов'язують з активацією їх генетичного апарату - експресією ранніх генів, що негайно реагують, таких як c-fos, c-jun, junB та інші. Зокрема, продемонстровано позитивну кореляцію між кількістю fos-позитивних нейронів та ступенем болю. У механізмах активації протоонкогенів важлива роль відводиться іон Са 2+ . При підвищенні концентрації іонів Са 2+ у цитозолі, внаслідок посиленого їх входу через регульовані NMDA-рецепторами Са-канали, відбувається експресія с-fos, с-jun, білкові продукти яких беруть участь у регуляції довготривалої збудливості мембрани клітини . Останнім часом важливе значення в механізмах сенситизації ноцицептивних нейронів надається оксид азоту (NO), який у мозку виконує роль нетипового внесинаптичного медіатора.
Малі розміри та відсутність заряду дозволяють NO проникати через плазматичну мембрану та брати участь у міжклітинній передачі сигналу, функціонально з'єднуючи пост- та пресинаптичні нейрони. NO утворюється з L-аргініну в нейронах, що містять фермент NO-синтетазу. NO виділяється з клітин при NMDA-індукованому збудженні та взаємодіє з пресинаптичними терміналями С-аферентів, посилюючи викид з них збудливої амінокислоти глутамату та нейрокінінів [Кукушкін М. Л. та ін., 2002; Шуматов В. Б. та ін., 2002]. Оксид азоту грає ключову роль запальних процесах. Локальне введення інгібіторів NО синтази в суглоб ефективно блокує ноцицептивну передачу та запалення.
Усе це свідчить, що оксид азоту утворюється у запалених суглобах . Кініни є одними з найпотужніших алгогенних модуляторів. Вони швидко утворюються при пошкодженні тканини та викликають більшість ефектів, що спостерігаються при запаленні: вазодилатацію, збільшення судинної проникності, екстравазацію плазми, міграцію клітин, біль та гіпералгезію. Вони активують С-волокна, що призводить до нейрогенного запалення за рахунок викиду з нервових терміналей субстанції Р, кальцитонін генетичного пептиду та інших нейромедіаторів.
Прямий збуджуючий ефект брадикініну на чутливі нервові закінчення опосередковується B2-рецепторами і пов'язаний з активацією мембранної фосфоліпази С. Непряма збуджуюча дія брадикініну на закінчення нервових аферентів обумовлена його впливом на різні тканинні елементи, ендотеліальні клітини, фібробласти та фібробласти. утворення в них медіаторів запалення, які взаємодіючи з відповідними рецепторами на нервових закінченнях, активують мембранну аденілатциклазу. У свою чергу, аденілатциклаза та фосфоліпазу С стимулюють утворення ферментів, що фосфорилюють білки іонних каналів.
Результатом фосфорилювання білків іонних каналів є зміна проникності мембрани для іонів, що відбивається на збудливості нервових закінчень та здатності генерувати нервові імпульси. Брадикінін, діючи через В2-рецептори, стимулює утворення арахідонової кислоти з подальшим утворенням простагландинів, простациклінів, тромбоксанів та лейкотрієнів. Ці речовини, що мають виражену самостійну алгогенну дію, у свою чергу, потенціюють здатність гістаміну, серотоніну і брадикініну сенситизувати нервові закінчення. Внаслідок цього з немієлінізованих С-аферентів посилюється викид тахікінінів (субстанції Р та нейрокініна А), які, збільшуючи судинну проникність, ще більше підвищують локальну концентрацію медіаторів запалення. [Решетняк В. К., Кукушкін М. Л., 2001].
Застосування глюкокортикоїдів запобігає утворенню арахідонової кислоти за рахунок пригнічення активності фосфоліпази А2. В свою чергу, нестероїдні протизапальні препарати (НПЗЗ)перешкоджають утворенню циклічних ендопероксидів, зокрема простагландинів. Під загальною назвою НПЗП об'єднуються різні за хімічною будовою речовини, що надають інгібуючу дію на циклооксигеназу. Всі нестероїдні протизапальні засоби в тій чи іншій мірі мають протизапальний, жарознижувальний та аналгетичний ефект. На жаль, практично всі НПЗП при тривалому застосуванні мають виражену побічну дію. Вони викликають диспепсію, пептичні виразки та шлунково-кишкові кровотечі. Може виникати також незворотне зниження клубочкової фільтрації, що веде до інтерстиціального нефриту та гострої ниркової недостатності. Нестероїдні протизапальні засоби негативно впливають на мікроциркуляцію, можуть викликати бронхоспазм. [Філатова Є. Р., Вейн А. М., 1999; Чичасова Н. Ст, 2001; Насонов Є. Л., 2001].
В даний час відомо, що існує два різновиди циклооксигеназ. Циклооксигеназа-1 (ЦОГ-1) утворюється за умов норми, а циклооксигеназа-2 (ЦОГ-2) утворюється у процесі запалення. В даний час розробка ефективних НПЗП спрямована на створення виборчих інгібіторів ЦОГ-2, які на відміну від неселективних інгібіторів мають значно менш виражену побічну дію. Разом з тим є відомості про те, що препарати зі «збалансованою» інгібуючою активністю по відношенню до ЦОГ-1 і ЦОГ-2 можуть мати більш виражену протизапальну та аналгетичну активність порівняно зі специфічними інгібіторами ЦОГ-2 [Насонов Є. Л., 2001].
Поряд із розробкою препаратів, що інгібують ЦОГ-1 та ЦОГ-2, ведуться пошуки принципово нових аналгетичних препаратів. Передбачається, що за хронічне запалення відповідальні рецептори В1. Антагоністи цих рецепторів значно знижують прояви запалення. Крім того брадикінін бере участь у виробленні діацилгліцеролу та активує протеїнкіназу С, що, у свою чергу, посилює сенситизацію нервових клітин.
Протеїнкіназа С відіграє дуже важливу роль у ноцицепції, і зараз проводяться пошуки препаратів, здатних пригнічувати її активність. . Крім синтезу та викиду медіаторів запалення, гіперзбудливості спинальних ноцицептивних нейронів та посилення аферентного потоку, що йде в центральні структури мозку, певну роль відіграє активність симпатичної нервової системи. Встановлено, що підвищення чутливості терміналей ноцицептивних аферентів при активації симпатичних постгангліонарних волокон опосередковується двома шляхами. По-перше, за рахунок підвищення судинної проникності в зоні ушкодження та збільшення концентрації медіаторів запалення (непрямий шлях) і, по-друге, за рахунок прямого впливу нейротрансмітерів симпатичної нервової системи - норадреналіну та адреналіну на a2-адренорецептори, розташовані на мембрані ноцицепторів. При запаленні відбувається активація так званих «мовчазних» ноцицептивних нейронів, які без запалення не відповідають різного роду ноцицептивні подразнення.
Поряд із посиленням аферентного ноцицептивного потоку при запаленні відзначається посилення низхідного контролю . Це відбувається внаслідок активації антиноцицептивної системи. Вона активується, коли больовий сигнал досягає антиноцицептивних структур стовбура мозку, таламуса та кори великих півкуль мозку [Решетняк В. К., Кукушкін М. Л., 2001]. Активація навколоводопровідної сірої речовини та великого ядра шва викликає вивільнення ендорфінів та енкефалінів, які зв'язуються з рецепторами, запускаючи серію фізико-хімічних змін, що зменшують біль. Існують три основні типи опіатних рецепторів: ? -,? - І? -Рецептори. Найбільша кількість використовуваних анальгетиків надають свою дію завдяки взаємодії з? -рецепторами. Донедавна було прийнято вважати, що опіоїди діють виключно на нервову систему та викликають аналгетичний ефект за рахунок взаємодії з опіоїдними рецепторами, локалізованими в головному та спинному мозку. Однак опіатні рецептори та їх ліганди виявлені на імунних клітинах , у периферичних нервах , у запалених тканинах . В даний час відомо, що 70% рецепторів до ендорфіну та енкефалін розташовані в пресинаптичній мембрані ноцицепторів і найчастіше больовий сигнал пригнічується (перед тим як досягти задніх рогів спинного мозку).
Дінорфін активує? -рецептори та інгібує вставкові нейрони, що призводить до вивільнення ГАМК, яка викликає гіперполяризацію клітин заднього рогу та інгібує подальшу передачу сигналу . Опіоїдні рецептори розташовуються в спинному мозку головним чином навколо терміналів С-волокон у I пластині дорзальних рогів. . Вони синтезуються в тілах малих клітин дорзальних гангліїв і транспортуються проксимально та дистально за аксонами . Опіоїдні рецептори неактивні в незапалені тканини, після початку запалення ці рецептори активуються протягом декількох годин . Синтез опіатних рецепторів у нейронах гангліїв дорзальних рогів також збільшується при запаленні, але цей процес, включаючи час транспортування аксонами, становить кілька днів. . У клінічних дослідженнях встановлено, що ін'єкція 1 мг морфіну в колінний суглоб після видалення меніска дає виражений тривалий аналгетичний ефект. . Надалі було показано наявність опіатних рецепторів у запаленій синовіальній тканині. .
Слід зазначити, що здатність опіатівВикликати місцевий аналгетичний ефект при їх аплікації на тканині було описано ще у XVIII столітті. Так, англійський лікар Хеберден (Heberden) в 1774 опублікував роботу, в якій описав позитивний ефект аплікації екстракту опію при лікуванні гемороїдальних болів . Показаний добрий аналгетичний ефект діаморфінупри його локальній аплікації на місця пролежнів та на малігнізовані ділянки шкіри при видаленні зубів в умовах вираженого запалення навколишньої тканини. . Антиноцицептивні ефекти (що виникають протягом декількох хвилин після аплікації опіоїдів) залежать передусім від блокади поширення потенціалів дії, а також від зменшення викиду збуджуючих медіаторів, зокрема, субстанції Р із нервових закінчень .Морфін погано абсорбується через нормальну шкіру і добре всмоктується через запалену. Тому аплікація морфіну на шкіру дає лише локальний аналгетичний ефект і діє системно.
Останніми роками дедалі більше авторів починають говорити про доцільність застосування збалансованої аналгезії, тобто. поєднане застосування НПЗП та опіатних анальгетиківщо дозволяє знизити дози і відповідно побічні ефекти як перших, так і других. [Ігнатов Ю. Д., Зайцев А. А., 2001; Осипова Н. А., 1994; Філатова Є. Р., Вейн А. М., 1999; Насонов Є. Л., 2001].Опіоїди все частіше починають застосовуватися при артритичних болях [Ігнатов Ю. Д., Зайцев А. А., 2001]. Зокрема, на даний час із цією метою використовується болюсна форма трамадолу. Цей препарат є агоністом-антагоністом [Машковський М. Д., 1993]і тому ймовірність виникнення фізичної залежності при використанні адекватних доз невелика. Відомо, що опіоїди, що належать до групи агоністів-антагоністів, значно меншою мірою викликають фізичну залежність порівняно з істинними опіатами. [Філатова Є. Р., Вейн А. М., 1999].
Існує думка, що опіоїди, які використовуються в коректних дозах, безпечніші, ніж традиційні НПЗЗ [Ігнатов Ю. Д., Зайцев А. А., 2001]. Одним із найважливіших факторів хронізації болю є приєднання депресії. На думку деяких авторів, при лікуванні хронічного болю необхідно завжди використовувати антидепресанти незалежно від його патогенезу. [Філатова Є. Р., Вейн А. М., 1999].
Протибольовий ефект антидепресантівдосягається за рахунок трьох механізмів. Перший – зменшення депресивної симптоматики. Другий – антидепресанти активують серотонічні та норадренергічні антиноцицептивні системи. Третій механізм полягає в тому, що амітриптилін та інші трициклічні антидепресанти діють як антагоністи NMDA-рецепторів та взаємодіють з ендогенною аденозиновою системою. Таким чином, у патогенезі больових синдромів, що виникають при запаленні, бере участь велика кількість різних нейрофізіологічних та нейрохімічних механізмів, які неминуче призводять до змін у психофізіологічному статусі пацієнта. Тому поряд із протизапальними та аналгетичними препаратами для проведення комплексної патогенетично обґрунтованої терапії, як правило, необхідно призначати й антидепресанти.
Література
- Вальдман А. В., Ігнатов Ю. Д. Центральні механізми болю. - Л.: Наука, 1976. 191.
- Внутрішні хвороби. У 10 книжках. Книга 1. Пер з анг. За ред. Є. Браунвальда, К. Дж. Іссельбахера, Р. Г. Петерсдорфа та ін - М.: Медицина, 1993, 560.
- Ігнатов Ю. Д., Зайцев А. А. Сучасні аспекти терапії болю: опіати. Якісна клінічна практика 2001, 2, 2-13.
- Калюжний Л. В. Фізіологічні механізми регуляції больової чутливості. М: Медицина, 1984, 215.
- Кукушкін М. Л., Графова В.М., Смирнова В. І. та ін. Роль оксиду азоту в механізмах розвитку больового синдрому // Анестезіол. та реаніматол., 2002, 4, 4-6.
- Кукушкін М. Л., Решетняк В. К. Дизрегуляційні механізми патологічного болю. У Кн: Дизрегуляційна патологія. (За ред. Г. Н. Крижановського) М.: Медицина, 2002. 616 -634.
- Машковський М. Д. Лікарські засоби. 1993, М. Медицина, 763.
- Мелзак Р. Загадка болю. Пров. з англ. М: Медицина, 1981, 231 с.
- Насонов Е. Л. Аналгетичні ефекти нестероїдних протизапальних препаратів при захворюваннях опорно-рухового апарату: баланс ефективності та безпеки. Consilium medicum, 2001, 5, 209-215.
- Осипова Н. А. Сучасні засади клінічного застосування аналгетиків центральної дії. Анест. та реаніматол. 1994, 4, 16-20.
- Решетняк В. К. Нейрофізіологічні основи болю та рефлекторного знеболювання. Підсумки науки та техніки. ВІНІТИ. Фізіол. людини та тварин, 1985. 29. 39-103.
- Решетняк В. К., Кукушкін М. Л. Біль: фізіологічні та патофізіологічні аспекти. У Кн: Актуальні проблеми патофізіології (обрані лекції). За ред. Б. Б. Мороза. М: Медицина, 2001, 354-389.
- Решетняк В.К., Кукушкін М. Л. Вікові та статеві відмінності сприйняття болю // Клінічна геронтологія, 2003, Т 9, № 6, 34-38.
- Філатова Є. Р., Вейн А. М. Фармакологія болю. Російський медичний журнал, 1999, 9, 410-418.
- Чигодова Н. В. Локальне застосування аналгетичних засобів при захворюваннях суглобів та хребта. Consilium medicum, 2001, 5, 215-217.
- Шуматов В. Б., Шуматова Т. А., Балашова Т. В. Вплив епідуральної аналгезії морфіном на NO-утворюючу активність ноцицептивних нейронів спинальних гангліїв та спинного мозку. Анестезіол. та реаніматол., 2002, 4, 6-8.
- Back L. N., Finlay I. Analgesic effect of topical opioids on painful skin ulcers. // J. Pain Symptom Manage, 1995, 10, 493.
- Cabot PJ, Cramond T., Smith M.T. Eur. J. Pharmacol., 1996, 310, 47-53.
- Calixto J. B., Cabrini D. A., Ferreria J., Kinins in pain and inflammation. Pain, 2000, 87, 1-5
- Coderre T. J., Katz J., Vaccarino A. L., Melzack R. Створення центральної neuroplasticity до pathological pain: review of clinical and experimental evidence. Pain, 1993, 52, 259-285.
- Dickenson A. H. Where and how do opioids act. Процедури 7th World Congress on Pain, Progress in Pain Research and Management, edited G. F. Gebhart, D. L. Hammond and TS Jensen, IASP Press, Seattle, 1994, 2, 525-552.
- Dickenson A. H. Pharmacology of pain transmission and control. Pain, 1996. 1996, 113-121.
- Hassan A. H. S., Ableitner A., Stein C., Herz A. Inflamation of rat paw enhances axonal transport of opioid receptors in sciatic nerve and increases their density in inflamed tissue.// Neurosci.., 1993, 55, P. 185-195.
- Krainik M., Zylicz Z. Topical morphine для malignant cutaneouspain. Palliative. Med., 1997, 11, 325.
- Krajnik M., Zylicz Z., Finlay I. та ін. Потенційні використання topical opioids в palliative care-report of 6 cases. Pain, 1999, 80, 121-125.
- Lawand N. B., McNearney T., Wtstlund N. Amino acid виконаний в кнеї joint: key role in nociception and inflammation, Pain, 2000, 86, 69-74.
- Lawrence A. J., Joshi G. P., Michalkiewicz A. та ін. Evidence for analgesia mediated by peripheral opioid receptors in inflamed synovial tissue.// Eur. J. Clin. Pharmacol., 1992, 43, P. 351-355.
- Likar R., Sittl R., Gragger K. та ін. Peripheral morphine analgesia in dental surgery. Pain, 1998, 76, 145-150.
- Likar R., Sittl R., Gragger K. та ін. Opiate receptors. Its demonstration в nervous tissue.Science, 1973, 179, 1011-1014.
- Przewlocki R., Hassan A. H. S., Lason W. et al. Gene expression and localization of opioid peptides in immune cells of inflamed tissue: functional role in antinociception. Neurosci., 1992, 48, 491-500.
- Ren K., Dubner R. Збільшена деградація modulation nociception in rats with persistent hindpaw inflammation. J. neurophysiol, 1996, 76, 3025-3037.
- Schafer M., Imai Y., Uhl G. R., Stein C. Inflammation поліпшення периферійного mu-опіоіду receptor-mediated analgesia, але не m-опіоід receptor transcription in dorsal root ganglia.// Eur. J. Pharmacol., 1995, 279, 165-169.
- Stein C., Comisel K., Haimerl E. та ін. Analgesic effect of intraarticular morphine after arthroscopic knee surgery. // N. Engl. Med., 1991; 325: p. 1123-1126.
- Torebjork E., Nociceptor dynamics in human, в: G. F. Gebhart, D. L. Hammond і T. S. Jensen (Eds.), Процедури 7th World Congress on Pain. Progress in Pain Research and Management, IASP Press, Seattle, WA, 1994, 2, pp. 277-284.
- Wall P. D., Melzack R. (Eds) Textbook of pain, 3rd ed., Churchill Livingstone, Edinbugh, 1994.
- Wei F., Dubner R., Ren K. Nucleus reticularis gigantocellularis і nucleus raphe magnus в блискавому тім екстремальних ефектів на біологічних hyperalgesia і spinal Fos protein expression after peripheral inflammation. Pain, 1999, 80, 127-141.
- Wei R., Ren K., Dubner R. Inflammation-induced Fos protein expression в ліхтарі pin cord is enhanced following dorsolateral or ventrolateral funiculus lesions. Brain Res., 1998, 782, 116-141.
- Wilcax G. L. IASP Refresher Courses on Pain Management, 1999, 573-591.
- Willis W. D. Signal transduction mechanisms. Pain 1996 - An Updated Review. Refresher Course Syllabus (8th World Congress on Pain), IASP Press, Seattle, WA, 1996, 527-531.
- Zimlichman R., Gefel D., Eliahou H. та ін. Expression of opioid receptors під час серця ontogeny в normotensive і hypertensive rats. // Circulation, 1996; 93: p. 1020–1025.
Розрізняють протопатичну і епікритичну біль (больову чутливість).
Епікритична ("Швидка", "перша", "попереджувальна") біль виникає в результаті впливу подразників малої та середньої сили. Властивості епікритичного болю наведені у таблиці.
Порівняльнахарактеристикаепікритичнійіпротопатичнеболі. Властивість болю | Епікритичний біль | Протопатичний біль |
Джерело подразника | шкіра, слизові оболонки | внутрішні органи та тканини |
Латентний період | короткий | тривалий |
Тривалість після усунення подразника | швидко припиняється | довго зберігається |
Тип провідного волокна | мієлінові, тип А | безмієлінові, тип С |
Поріг сприйняття | низький | високий |
Локалізованість | точна | дифузна |
Примітка. Характеристики різних типівнервових волокон наведено у статті “Волокно нервове” у додатку “Довідник термінів”.
Протопатична (“повільна”, “тяжка”, “давня”) біль виникає під впливом сильних, “руйнівних”, “масштабних” подразників. Властивості протопатичного болю наведено у табл.
Тільки поєднана – і протопатична, і епікритична – чутливість дає можливість тонко оцінити локалізацію впливу, його характер та силу.
(Підручник П.Ф.Литвицького)Класифікація болю.
Нині запропоновано кілька класифікацій болю. Залежно від локалізації ушкодження, біль може бути розділений: на соматичний поверхневий (у разі пошкодження шкірних покривів), соматичний глибокий (при ушкодженні кістково-м'язової системи), вісцеральний (при ушкодженні внутрішніх органів). Болі, що виникають при пошкодженні периферичних нервів, називають нейропатичними болями, а при пошкодженні структур центральної нервової системи - центральними болями. У разі не збігу болю з місцем ушкодження виділяють проектований і відбитий біль. Наприклад, при здавленні спинномозкових корінців, біль проектується в області тіла, що иннервируются ними. Відбитий біль виникає внаслідок пошкодження внутрішніх органів та локалізується у віддалених поверхневих ділянках тіла. Так стосовно шкірної поверхні біль відбивається на відповідному дерматомі, наприклад у вигляді зон Захар'їна-Геда.
У клініці для акцентування уваги причинах, що викликали біль, використовується етіологічна класифікація. Прикладами таких болів є післяопераційний біль, онкологічні болі, болі при артритах та ін.
p align="justify"> Особливе значення для диференційованої терапії больових синдромів має патогенетична класифікація, заснована на виділенні головного, провідного механізму у формуванні патологічного болю. Відповідно до цієї класифікації розрізняють три основні типи больових синдромів:
соматогенний (ноцицептивний);
нейрогенний;
психогенний.
У свою чергу, соматогенний біль поділяють на:
соматичнуі вісцеральну. Клінічно серед них виділяють: посттравматичний та післяопераційний больові синдроми, болі при запаленні суглобів, міофасціальні больові синдроми, судинні болі, біль у онкологічних хворих, стенокардію, біль при жовчно-кам'яній хворобі та багато інших.
Розвиток нейрогенних больових синдромів пов'язують із пошкодженням периферичних або центральних структур ноцицептивної системи та формуванням у них стійких агрегатів гіперактивних нейронів.
Прикладами таких больових синдромів є невралгія трійчастого нерва, фантомно-больовий синдром, таламічні болі, каузальгія
Особливу групу складають психогенні біль або біль психологічної природи, які можуть виникати незалежно від соматичних, вісцеральних або нейрональних ушкоджень і більшою мірою визначаються психологічними та соціальними факторами.
Одним із механізмів формування такого типу болів є обумовлене психо-емоційними факторами рефлекторна напруга м'язів, що призводить до розвитку в зоні напруги ішемізації тканин та хворобливого дискомфорту. Найбільш типовим прикладом є головний більнапруги. При тривожно-фобічних станах біль може розглядатися як конверсійний процес, що перетворює психологічний конфлікт на фізичне страждання, яке підтримується чи посилюється негативними спогадами та думками. Крім цього, психогенні болі можуть виникати як марення або галюцинація у пацієнтів з психозами і зникати при лікуванні основного захворювання.
За тимчасовими параметрами виділяють гоструі хронічнубіль.
Гострабіль - це новий, недавній біль, нерозривно пов'язаний з його пошкодженням і, як правило, є симптомом будь-якого захворювання. Такий біль зникає під час усунення пошкодження.
Хронічнабіль часто набуває статусу самостійної хвороби, триває тривалий період часу навіть після усунення причини, що викликала гострий біль.
У ряді випадків причина хронічного болю взагалі може не визначатися. Патогенез хронічного больового синдрому складний та пов'язаний з формуванням особливого патодинамічного стану – патологічної алгічної системи, яка є основою стереотипної больової поведінки. У разі необхідно пам'ятати, що біль - це, передусім, неприємне відчуття, що супроводжується емоційним напругою. Відповідно до визначення Комітету з упорядкування термінів IASP, активність, що виникає в ноцицепторах та ноцицептивних шляхах при пошкоджуючих стимулах, не є болем, а відображає процес виявлення та передачі сигналу. Кінцева ж оцінка (сприйняття) ноцицептивних сигналів нашою свідомістю у вигляді відчуття, емоції та реакції залежать від багатьох психологічних та соціальних факторів. Біль завжди суб'єктивний. Те саме роздратування може сприйматися нашою свідомістю по-різному. Невпевненість у собі, страх посилюють біль, тоді як гнів та лють знижують больову чутливість. Сприйняття болю залежить не тільки від місця та характеру ушкодження, а й від умов чи обставин, за яких відбулося ушкодження, від психологічного стану людини, її індивідуального життєвого досвіду та культури. Завдяки процесу впізнавання, порівняння поточного болю з попереднім больовим досвідом багато в чому визначається кінцевий прояв болю - вираженість міміки, наявність або відсутність стогонів, ступінь страждання, які за допомогою механізмів пам'яті закріплюються в особливе “больове поведінка", характерне для пацієнтів, які страждають на хронічний больовий синдром. Необхідно наголосити, що для хронічних больових синдромів характерна комбінація патогенетичних механізмів, коли до провідного основного механізму (соматогенного або нейрогенного) приєднується психогенний, що посилює клінічні проявибіль. Тому при лікуванні хронічних больових синдромів поряд з етіопатогенетичною терапією, необхідна продумана корекція особистісно-психологічних проблем з використанням психотерапевтичних методів (гіпноз, аутотренінг, групова або сімейна психотерапія).
Вікові та статеві відмінності сприйняття болю
При діагностиці та лікуванні цілого ряду больових синдромів необхідно враховувати особливості больового сприйняття у людей різної статі та різного віку. Це особливо важливо за наявності больових синдромів вісцерального генезу. Клінічні спостереження в більшості випадків свідчать про те, що інтенсивність больового сприйняття знижується з віком.
Чоловіки та жінки сприймають та переносять біль по-різному. З хірургічної практики відомо, що дівчатка та жінки у перші дні післяопераційного періодучастіше скаржаться на біль ніж хлопчики та чоловіки. При проведенні стоматологічних процедур також зазначено, що жінки відчувають більш інтенсивні болючі відчуття, ніж чоловіки. При пред'явленні однакових інтенсивністю больових подразників жінок об'єктивний показник болю (розширення зіниці) виражений більше. Спеціальне дослідження проведене на новонароджених показало, що дівчатка виявляють більш виражену мімічну реакцію у відповідь больове роздратування ніж хлопчики. Вважається, що особливості сприйняття болю у чоловіків та жінок обумовлені гормональними відмінностями між статями. При деяких больових станах у жінок описані відмінності у сприйнятті болю в залежності від дозрівання, вагітності, менопаузи та старіння. У чоловіків також деякі больові патології виявляють різний характер у різні періоди життя. Крім того, у жінок різні формиболі змінюються залежно від фази менструального циклу. Прогестерон асоціюється з аналгезією та анестезією тому, що деякі болючі стани (мігрень) проходять або слабшають при вагітності або в середині лютеїнової фази менструального циклу, а інші типи болю слабшають у тварин під час лактації (коли рівень прогестерону підвищений). Естроген може посилювати загоєння ран і також може викликати аналгезію, оскільки деякі больові стани посилюються після менопаузи, коли естроген знижується (наприклад, суглобові та вагінальні болі). Подібні міркування відносяться і до тестостерону, тому що деякі болючі симптоми, наприклад, стенокардія, стають більш вираженими у чоловіків, коли з віком тестостерон знижується.
В експериментах на тваринах показано, що статеві гормони, зокрема, естроген і прогестерон впливають на опіатну систему, що бере участь у механізмах антиноцицепції.
Число дітей і підлітків страждають на хронічні больові синдроми різного генезу може досягати 10-12% від всієї популяції. Дівчатка відчувають хронічний біль частіше, ніж хлопчики, і найбільша частота випадків хронічного болю у дівчаток відзначається у 12-14 років. Незалежно від статі можуть одночасно бути присутніми кілька хронічних больових синдромів.
У пацієнтів старше 65 років кількість безболісних інфарктів та безболевих виразок шлунка збільшується. Однак це не свідчить про зниження больового сприйняття. У людей похилого віку знижена пластичність ЦНС, що проявляється уповільненим відновленням і збільшенням тривалості болю після пошкодження тканин.
Чоловіки та жінки сприймають біль по-різному. У дівчаток і жінок пороги больового сприйняття та толерантність до болю нижчі, ніж у хлопчиків та чоловіків. Жінки частіше, ніж чоловіки протягом життя відчувають головні та вісцеральні болі, як гострого характеру, так і хронічні. Вісцеральний біль при певних патологіях внутрішніх органів менш передбачуваний у жінок, ніж у чоловіків, внаслідок чого ці патології гірше діагностуються та лікуються у жінок. Тому в інтраопераційному та післяопераційному періодах жінки потребують більшого знеболювання, ніж чоловіки.
Патофізіологія болю
Тепер, маючи деякі уявлення про біль, важливо розібратися у відмінностях між гострим (фізіологічним) та хронічним болем і усвідомити, що патологічний (хронічний) біль, не симптом хвороби, а самостійний патологічний процес, або захворювання.
Фізіологічний біль.
У розвитку уявлень про сприйняття болю організмом людини виділяють 3 основні етапи (три основні теорії):
теорія «специфічності»
теорія «воротного контролю»
теорія нейроматриксу
Перший етап.
До середини 20-го століття сформувалася « теорія специфічності» згідно з якою, біль являє собою окрему сенсорну систему, в якій будь-який пошкоджуючий стимул активує спеціальні больові рецептори (ноцицептори), що передають больовий імпульс спеціальними нервовими шляхами в спинний мозок і в больові центри головного мозку, викликаючи захисну реакцію у відповідь, спрямовану на віддалення від подразника (див. попередній розділ). Психологічне відчуття болю, її сприйняття та переживання визнаються адекватними та пропорційними до фізичної травми та периферичного пошкодження. На практиці це становище призвело до того, що пацієнти, які страждають на біль і не мають очевидних ознак органічної патології, стали вважатися "іпохондриками", "невротиками" і, у кращому випадку, прямували на лікування до психіатра або психотерапевта.
Другий етап.
Багато дослідників розуміли недосконалість теорії специфічності, що відводила центральній нервовій системі роль пасивного приймача больових імпульсів. Паралельно з теорією специфічності було запропоновано кілька варіантів "теорії патернів", заснованої на уявленнях про сумацію нервових подразнень до певного порога, за яким виникає больове відчуття.
У 60-ті роки 20-го століття сформувалася і в 70-ті теорія, що стала загальновизнаною. комірного контролю":
1.Передача нервових імпульсів до центральної нервової системи модулюється спеціальними "воротними" механізмами, розташованими в задніх рогах спинного мозку.
2.Спінальні "воротні" механізми, у свою чергу, регулюються низхідними імпульсами від головного мозку.
3.При досягненні критичного рівня потік імпульсів від нейронів спинного мозку активує "Систему дії" - нейрональні зони центральної нервової системи, які формують складні поведінкові реакції на біль.
Теорія "воротного контролю" мала велике практичне значення. Методи перерізання нервів стали заміщатися методами на вхідну спинний мозок інформацію. Фізіотерапевти, рефлексотерапевти та фахівці в області лікувальної гімнастики, використовують безліч модулюючих методик, включаючи акупунктуру та черезшкірну електронейростимуляцію (ЧЕНС в терапії гострого та хронічного болю).
Ця теорія визнає спинний і головний мозок активною системою, що фільтрує, відбирає та впливає на вхідні сенсорні сигнали. Теорія затвердила центральну нервову систему провідною ланкою у больових процесах.
Третій етап
Згодом з'явилися факти, незрозумілі з позиції теорії «воротного контролю». Спостереження хворих з параплегією, тобто. з перервою спинного мозку, і пацієнтами, які страждають на фантомні болі, що зберігають переживання і відчуття вже відсутніх частин тіла привели до наступних висновків:
по-перше, оскільки фантомна кінцівка відчувається настільки реальною, то випливає, що її нормальне відчуття обумовлено процесами в самому головному мозку, а значить, може виникати і відсутність вхідних пропріоцептивних сигналів;
по-друге, оскільки всі сенсорні відчуття, включаючи біль, також можуть виникати без подразників, можна вважати, що джерела виникнення нервових патернів, що формують якість переживання, знаходяться не в периферичній нервовій системі, а в нейрональних мережах головного мозку.
Отже, сприйняття власного тіла та його різноманітних відчуттів обумовлено центральними процесами в головному мозку, генетично детерміновано та може лише модифікуватися під впливом периферичних сигналів та минулого досвіду.
Цей висновок став основою теорії, яка стверджувала нову концептуальну модель нервової системи, теорії. нейроматриксу.
Нейроматрикс є великою мережею нейронів, що утворюють функціональні петлі між таламусом і корою, корою і лімбічною системою. Синаптичні зв'язки в цій нейронної мережігенетично детерміновані і, у певному сенсі, становлять материнську "матрицю", що генерує, відтворює та модулює сенсорну інформацію.
Однак, хоча нейроматрикс і зумовлений генетичними факторами, його синаптична індивідуальна архітектура формується і визначається вступниками до нього протягом життєдіяльності людини сенсорними сигналами та впливами. Нейроматрикс є нероздільною єдністю спадковості, досвіду та навчання.
Теорія нейроматрикса стверджує, що це якісні характеристики больового відчуття генетично детерміновані і генеруються у головному мозку, а периферичні стимули представляють лише їх неспецифічні " тригери " .
Згідно з новою концепцією головний мозок не тільки сприймає, аналізує та модулює вхідні сенсорні сигнали. Він має властивість генерувати больову перцепцію навіть у випадках, коли ніякі зовнішні імпульси та подразнення з периферії не надходять.
Теорія нейроматрикса ймовірно матиме значну клінічну цінність у лікуванні завзятих, зокрема, фантомних болів. Так, наприклад, введення місцевого анестетика(лідокаїну) у певні зони головного мозку (боковий гіпоталамус, зубчасте ядро та ін.), що робиться досить легко та безпечно, може блокувати процес формування больових нейросигнатур на період, значно більший, ніж тривалість фармакологічної діїпрепарату
Антиноцицептивна система
Комплекс ноцицептивної системи однаково збалансований в організмі комплексом антиноцицептивної системи, що забезпечує контроль за активністю структур, що беруть участь у сприйнятті, проведенні та аналізі больових сигналів.
В даний час встановлено, що больові сигнали, що надходять з периферії, стимулюють активність різних відділів центральної нервової системи (біля сіра речовина, ядра шва стовбура мозку, ядра ретикулярної формації, ядра таламуса, внутрішньої капсули, мозочка, інтернейрони задніх рогів спинного мозку. ) надають низхідну гальмівну дію на передачу ноцицептивної аферентації в дорзальних рогах спинного мозку.
У механізмах розвитку аналгезії найбільше значення надається серотонінергічній, норадренергічній, ГАМКергічній та опіоїдергічній системам мозку.
Основна з них, опіоїдергічна система, утворена нейронами, тіло та відростки яких містять опіоїдні пептиди (бета-ендорфін, мет-енкефалін, лей-енкефалін, динорфін).
Зв'язуючись з певними групами специфічних опіоїдних рецепторів (мю-, дельта- і каппа-опіоїдні рецептори), 90% яких розташовано в дорзальних рогах спинного мозку, вони сприяють вивільненню різних хімічних речовин (гамма-аміномасляна кислота), гальмують гальмують гальмівних .
Ця природна, природна болезаспокійлива система важлива для нормальної життєдіяльності, як і болесигналізуюча система. Завдяки їй, незначні пошкодження типу забиття пальця або розтягнення зв'язок викликають сильні болючі відчуття лише на короткий час - від кілька хвилин до декількох годин, не змушуючи нас страждати протягом днів і тижнів, що сталося б в умовах збереження болю до повного загоєння.
Таким чином, фізіологічна ноцицепція включає чотири основні процеси:
1.Трансдукцію - процес, при якому шкідливий вплив трансформується у вигляді електричної активностіу вільних неінкапсульованих нервових закінченнях (ноцицепторах). Їх активація відбувається або внаслідок прямих механічних або термічних стимулів, або під впливом ендогенних тканинних та плазмових алгогенів, що утворюються при травмі чи запаленні (гістамін, серотонін, простагландини, простацикліни, цитокіни, іони К+ та Н+, брадикінін).
2.Трансмісію - проведення виниклих імпульсів по системі чутливих нервових волокон і шляхів до центральної нервової системи (тонкі мієлінові А-дельта і тонкі безмієлінові С-аференти у складі аксонів спинномозкових гангліїв та задніх спинномозкових корінців, спиномезенічні, спиномезенічні, спиномезенічні задніх рогів спинного мозку до утворень таламуса та лімбіко-ретикулярного комплексу, таламокортикальні шляхи до соматосенсорних та фронтальних зон кори головного мозку).
3.Модуляцію – процес зміни ноцицептивної інформації низхідними, антиноцицептивними впливами центральної нервової системи, мішенню яких є переважно нейрони задніх рогів спинного мозку (опіоїдергічні та моноамінові нейрохімічні антиноцицептивні системи та система комірного контролю).
4.Перцепцію - суб'єктивне емоційне відчуття, що сприймається як біль і що формується під впливом фонових генетично детермінованих властивостей центральної нервової системи та ситуаційно мінливих подразнень з периферії. (Цитую за автором
Це перший із описаних лікарями Стародавньої Греції та Риму симптомів – ознак запального ушкодження. Біль - це те, що сигналізує нам про якесь неблагополуччя, що виникає всередині організму або про дію якогось руйнівного та дратівливого фактора ззовні.
Біль, на думку широко відомого російського фізіолога П. Анохіна, покликана мобілізувати різноманітні функціональні системи організму для його захисту від впливу шкідливих факторів. Біль включає в себе такі компоненти як: відчуття, соматичні (тілесні), вегетативні та поведінкові реакції, свідомість, пам'ять, емоції та мотивації. Таким чином, біль є інтегративною функцією цілісного живого організму. В даному випадку - людського організму. Бо живі організми, навіть не маючи ознак вищої нервової діяльності, можуть відчувати біль.
Існують факти зміни електричних потенціалів у рослин, які фіксувалися при пошкодженні їх частин, а також такі ж електричні реакції, коли дослідники завдавали травми сусіднім рослинам. Таким чином, рослини реагували на ушкодження, що завдаються їм або сусіднім рослинам. Лише біль має такий своєрідний еквівалент. Ось така цікава, можна сказати, універсальна властивість усіх біологічних організмів.
Види болю – фізіологічна (гостра) та патологічна (хронічна).
Біль буває фізіологічної (гострої)і патологічної (хронічної).Гострий біль
За образним висловом академіка І.П. Павлова, є найважливішим еволюційним придбанням, і потрібно захисту від впливу руйнівних чинників. Сенс фізіологічного болю полягає у відкиданні всього, що загрожує життєвому процесу, порушує рівновагу організму з внутрішнім та зовнішнім середовищем.Хронічний біль
Це дещо складніше, яке формується в результаті патологічних процесів, що тривало існують в організмі. Ці процеси можуть бути як вродженими, так і набутими протягом життя. До набутих патологічних процесів відносять такі – тривале існування вогнищ запалення, які мають різні причини, всілякі новоутворення (доброякісні та злоякісні), травматичні ушкодження, операційні втручання, наслідки запальних процесів(наприклад, утворення спайок між органами, зміна властивостей тканин, що входять до їхнього складу). До вроджених патологічних процесів належать такі – різні аномалії розташування внутрішніх органів (наприклад, розташування серця зовні грудної клітки), вроджені аномалії розвитку (наприклад, вроджений дивертикул кишечника та інші). Таким чином, тривале існуюче вогнище пошкодження призводить до постійних і невеликих ушкоджень структур організму, що також постійно створює больову імпульсацію про пошкодження даних структур організму, порушених хронічним патологічним процесом.Так як дані пошкодження мінімальні, то і больові імпульси досить слабкі, а біль стає постійним, хронічним і супроводжує людину повсюдно і практично цілодобово. Біль стає звичним, проте нікуди не зникає і залишається джерелом тривалого подразнення. Больовий синдром, який існує у людини шість або більше місяців, призводить до значних змін в організмі людини. Відбувається порушення провідних механізмів регулювання найважливіших функцій організму людини, дезорганізація поведінки та психіки. Страждає соціальна, сімейна та особистісна адаптація даного конкретного індивіда.
Як часто трапляються хронічні болі?
Згідно з дослідженнями Всесвітньої Організації Охорони здоров'я (ВООЗ), кожен п'ятий житель планети страждає на хронічні болі, що завдаються всілякими патологічними станами, пов'язаними із захворюваннями різних органів і систем організму. Це означає, що як мінімум 20% людей страждають на хронічні болі різного ступеня вираженості, різної інтенсивності та тривалості.
Що таке біль і як він виникає? Відділ нервової системи відповідальний за передачу больової чутливості, речовини, що викликають і підтримують больові відчуття.
Відчуття болю являє собою складний фізіологічний процес, що включає периферичні та центральні механізмиі має емоційне, психічне, а найчастіше і вегетативне забарвлення. Механізми больового феномену повністю на сьогоднішній день не розкрито, незважаючи на численні наукові дослідження, які продовжуються аж до сьогодні. Однак розглянемо основні етапи та механізми сприйняття болю.Нервові клітини, які передають больовий сигнал, види нервових волокон.
 Найперший етап сприйняття болю є впливом на больові рецептори ( ноцицептори). Дані больові рецептори розташовані у всіх внутрішніх органах, кістках, зв'язках, у шкірі, на слизових оболонках різних органів, що стикаються із зовнішнім середовищем (наприклад, на слизовій оболонці кишечника, носа, горла і т.д.).
Найперший етап сприйняття болю є впливом на больові рецептори ( ноцицептори). Дані больові рецептори розташовані у всіх внутрішніх органах, кістках, зв'язках, у шкірі, на слизових оболонках різних органів, що стикаються із зовнішнім середовищем (наприклад, на слизовій оболонці кишечника, носа, горла і т.д.). На сьогоднішній день виділяють два основні види больових рецепторів: перші - це вільні нервові закінчення, при подразненні яких виникає відчуття тупого, розлитого болю, а другі є складними больовими рецепторами, при збудженні яких виникає відчуття гострого і локалізованого болю. Тобто характер больових відчуттів безпосередньо залежить від того, які больові рецептори сприйняли. дратівливий вплив. Щодо специфічних агентів, які можуть дратувати больові рецептори, можна сказати, що до них належать різні біологічно активні речовини (БАВ), що утворюються в патологічних осередках (так звані, алгогенні речовини). До цих речовин відносяться різні хімічні сполуки - це і біогенні аміни, і продукти запалення та розпаду клітин, і продукти локальних імунних реакцій. Всі ці речовини, зовсім різні за хімічною структурою, здатні чинити подразнюючу дію на больові рецептори різної локалізації.
Простагландини – речовини, що підтримують запальну реакцію організму.
Однак, існує ряд хімічних сполук, що беруть участь у біохімічних реакціях, які самі безпосередньо не можуть впливати на болючі рецептори, проте посилюють ефекти речовин, що викликають запалення. До класу даних речовин, наприклад, належать простагландини. Простагландини утворюються з особливих речовин – фосфоліпідів, які становлять основу клітинної мембрани Дані процес протікає наступним чином: якийсь патологічний агент (наприклад, ферментів утворюються простагландини та лейкотрієни. Простагландини та лейкотрієни в цілому називаються ейкозаноїдита відіграють важливу роль у розвитку запальної реакції. Доведено роль простагландинів у формуванні больових відчуттів при ендометріозі, передменструальному синдромі, а також синдромі хворобливих менструацій (альгодисменореї).Отже, ми розглянули перший етап формування больового відчуття – вплив на спеціальні болючі рецептори. Розглянемо, що відбувається далі, яким чином людина відчуває біль певної локалізації та характеру. Для розуміння цього процесу необхідно ознайомитися з провідними шляхами.
Як больовий сигнал надходить у головний мозок? Больовий рецептор, периферичний нерв, спинний мозок, таламус – докладніше про них.
 Біоелектричний больовий сигнал, що сформувався в больовому рецепторі, за кількома типами нервових провідників (периферичних нервів), минаючи внутрішньоорганні та внутрішньопорожнинні нервові вузли, прямує до спинальним нервовим гангліям (вузлам)розташований поруч зі спинним мозком. Ці нервові ганглії супроводжують кожен хребець від шийних до деяких поперекових. Таким чином, утворюється ланцюжок нервових гангліїв, що йде праворуч і зліва вздовж хребетного стовпа. Кожен нервовий ганглій пов'язаний із відповідною ділянкою (сегментом) спинного мозку. Подальший шлях больового імпульсу зі спинальних нервових гангліїв прямує у спинний мозок, який безпосередньо з'єднаний із нервовими волокнами.
Біоелектричний больовий сигнал, що сформувався в больовому рецепторі, за кількома типами нервових провідників (периферичних нервів), минаючи внутрішньоорганні та внутрішньопорожнинні нервові вузли, прямує до спинальним нервовим гангліям (вузлам)розташований поруч зі спинним мозком. Ці нервові ганглії супроводжують кожен хребець від шийних до деяких поперекових. Таким чином, утворюється ланцюжок нервових гангліїв, що йде праворуч і зліва вздовж хребетного стовпа. Кожен нервовий ганглій пов'язаний із відповідною ділянкою (сегментом) спинного мозку. Подальший шлях больового імпульсу зі спинальних нервових гангліїв прямує у спинний мозок, який безпосередньо з'єднаний із нервовими волокнами. 
Насправді спинний міг – це неоднорідна структура – у ньому виділяють білу та сіру речовину (як і в головному мозку). Якщо спинний мозок розглянути на поперечному розрізі, то сіра речовина буде виглядати як крила метелика, а біла буде оточувати його з усіх боків, формуючи округлі контури меж спинного мозку. Так ось, задня частинацих крилець метелика називається задніми рогамиспинного мозку. Ними нервові імпульси переправляються до головного мозку. Передні ж роги, за логікою, повинні розташовуватися в передній частині крил – так воно і відбувається. Саме передні роги проводять нервовий імпульс від головного мозку до периферичних нервів. Також у спинному мозку в центральній його частині існують структури, які безпосередньо з'єднують нервові клітинипередніх і задніх рогів спинного мозку – завдяки цьому є можливість формування так званої «лагідної» рефлекторної дуги», коли деякі рухи відбуваються неусвідомлено – тобто без участі головного мозку. Прикладом роботи короткої рефлекторної дуги є смикання руки від гарячого предмета.
 Оскільки спинний мозок має сегментарну будову, отже, кожен сегмент спинного мозку входять нервові провідники зі своєї зони відповідальності. За наявності гострого подразника з клітин задніх рогів спинного мозку збудження може різко перемикатися на клітини передніх рогів спинномозкового сегмента, що викликає блискавичну рухову реакцію. Торкнулися рукою гарячого предмета – одразу одразу руку. При цьому больова імпульсація все одно досягає кори головного мозку, і ми усвідомлюємо, що торкнулися гарячого предмета, хоча руку вже рефлекторно відсмикнули. Подібні нервово-рефлекторні дуги для окремих сегментів спинного мозку та чутливих периферичних ділянок можуть відрізнятися у побудові рівнів участі центральної нервової системи.
Оскільки спинний мозок має сегментарну будову, отже, кожен сегмент спинного мозку входять нервові провідники зі своєї зони відповідальності. За наявності гострого подразника з клітин задніх рогів спинного мозку збудження може різко перемикатися на клітини передніх рогів спинномозкового сегмента, що викликає блискавичну рухову реакцію. Торкнулися рукою гарячого предмета – одразу одразу руку. При цьому больова імпульсація все одно досягає кори головного мозку, і ми усвідомлюємо, що торкнулися гарячого предмета, хоча руку вже рефлекторно відсмикнули. Подібні нервово-рефлекторні дуги для окремих сегментів спинного мозку та чутливих периферичних ділянок можуть відрізнятися у побудові рівнів участі центральної нервової системи.
Як нервовий імпульс сягає головного мозку?
 Далі із задніх рогів спинного мозку шлях больової чутливості прямує до вищележачих відділів центральної нервової системи за двома шляхами – так званими «старими» і «новими» спиноталамічними (шляхом нервового імпульсу: спинний мозок – таламус) шляхами. Назви "старий" і "новий" є умовними і говорять лише про час появи зазначених шляхів на історичному відрізку еволюції нервової системи. Не будемо, однак, вдаватися в проміжні етапи досить складного нервового шляху, обмежимося лише констатацією факту, що обидва зазначені шляхи больової чутливості закінчуються в ділянках чутливої кори головного мозку. І "старий", і "новий" спиноталамічні шляхи проходять через таламус (особлива ділянка головного мозку), а "старий" спиноталамічний шлях - ще й через комплекс структур лімбічної системи мозку. Структури лімбічної системи мозку багато в чому беруть участь у освіті емоцій та формуванні поведінкових реакцій.
Далі із задніх рогів спинного мозку шлях больової чутливості прямує до вищележачих відділів центральної нервової системи за двома шляхами – так званими «старими» і «новими» спиноталамічними (шляхом нервового імпульсу: спинний мозок – таламус) шляхами. Назви "старий" і "новий" є умовними і говорять лише про час появи зазначених шляхів на історичному відрізку еволюції нервової системи. Не будемо, однак, вдаватися в проміжні етапи досить складного нервового шляху, обмежимося лише констатацією факту, що обидва зазначені шляхи больової чутливості закінчуються в ділянках чутливої кори головного мозку. І "старий", і "новий" спиноталамічні шляхи проходять через таламус (особлива ділянка головного мозку), а "старий" спиноталамічний шлях - ще й через комплекс структур лімбічної системи мозку. Структури лімбічної системи мозку багато в чому беруть участь у освіті емоцій та формуванні поведінкових реакцій. Передбачається, що перша, більш еволюційно молода система («новий» спиноталамічний шлях) проведення больової чутливості малює більш певний і локалізований біль, друга ж, еволюційно більш давня («старий» спиноталамічний шлях) служить для проведення імпульсів, що дають відчуття тягучої, погано локалізованої біль. Додатково до цього зазначена «стара» спиноталамічна система забезпечує емоційне забарвлення больового відчуття, а також бере участь у формуванні поведінкових та мотиваційних складових емоційних переживань, пов'язаних з болем.
Перед досягненням чутливих ділянок кори головного мозку, больова імпульсація проходить так звану попередню обробку в певних відділах центральної нервової системи. Це вже згаданий таламус (зоровий бугор), гіпоталамус, сітчаста (ретикулярна) формація, ділянки середнього та довгастого мозку. Перший, і, мабуть, один із найважливіших фільтрів на шляху больової чутливості – це таламус. Усі відчуття із довкілля, від рецепторів внутрішніх органів – все проходить через таламус. Неймовірна кількість чутливої та больової імпульсації проходить щомиті, вдень і вночі через цю ділянку мозку. Ми не відчуваємо, як відбувається тертя клапанів серця, рух органів черевної порожнини, всіляких суглобових поверхонь одна про одну – і все це завдяки таламусу.
При порушенні роботи, так званої, антибольової системи (наприклад, у разі відсутності вироблення внутрішніх, власних морфіноподібних речовин, що виникла внаслідок вживання наркотичних засобів) вищезгаданий шквал всілякої больової та іншої чутливості просто захльостує головний мозок, призводячи до жахливих за тривалістю, силою та виразністю. емоційно-больовим відчуттям. Така причина, у дещо спрощеному вигляді, так званої «ломки» при дефіциті надходження ззовні морфіноподібних речовин на фоні тривалого прийому наркотичних засобів.
Як больовий імпульс обробляється головним мозком?
 Задні ядра таламуса дають інформацію про локалізації джерела болю, а його серединні ядра – про тривалість впливу подразнюючого агента. Гіпоталамус, як найважливіший регуляторний центр вегетативної нервової системи, бере участь в утворенні вегетативного компонента больової реакції опосередковано через залучення центрів регулюючих обмін речовин, роботу дихальної, серцево-судинної та інших систем організму. Ретикулярна формація координує частково оброблену інформацію. Особливо підкреслюється роль ретикулярної формації у формуванні відчуття болю як особливого інтегрованого стану організму, з включенням різноманітних біохімічних, вегетативних, соматичних складових. Лімбічна системамозку забезпечує негативну емоційну окраску. Сам процес усвідомлення болю як такої, визначення локалізації больового джерела (мається на увазі конкретна область власного тіла) в сукупності з найскладнішими та найрізноманітнішими реакціями на больову імпульсацію відбувається неодмінно за участю мозкової кори.
Задні ядра таламуса дають інформацію про локалізації джерела болю, а його серединні ядра – про тривалість впливу подразнюючого агента. Гіпоталамус, як найважливіший регуляторний центр вегетативної нервової системи, бере участь в утворенні вегетативного компонента больової реакції опосередковано через залучення центрів регулюючих обмін речовин, роботу дихальної, серцево-судинної та інших систем організму. Ретикулярна формація координує частково оброблену інформацію. Особливо підкреслюється роль ретикулярної формації у формуванні відчуття болю як особливого інтегрованого стану організму, з включенням різноманітних біохімічних, вегетативних, соматичних складових. Лімбічна системамозку забезпечує негативну емоційну окраску. Сам процес усвідомлення болю як такої, визначення локалізації больового джерела (мається на увазі конкретна область власного тіла) в сукупності з найскладнішими та найрізноманітнішими реакціями на больову імпульсацію відбувається неодмінно за участю мозкової кори. Сенсорні ділянки кори головного мозку є вищими модуляторами больової чутливості і відіграють роль, так званого, коркового аналізатора інформації про факт, тривалість та локалізація больового імпульсу. Саме на рівні кори відбувається інтеграція інформації від різних видівВ кінці минулого століття було виявлено, що кожен рівень побудови больової системи від рецепторного апарату до центральних аналізувальних систем мозку може мати властивість посилення больової імпульсації. Начебто свого роду трансформаторні підстанції на лініях електропередач.
Доводиться говорити навіть про, так звані, генератори патологічно посиленого збудження. Так, із сучасних позицій дані генератори розглядаються як патофізіологічні основи больових синдромів. Згадана теорія системних генераторних механізмів дозволяє пояснити, чому при незначному подразненні больова відповідь буває досить значною за відчуттями, чому після припинення дії подразника відчуття болю продовжує зберігатися, а також допомагає пояснити появу болю у відповідь на стимуляцію зон шкірної проекції (рефлексогенних зон) при патології внутрішніх органів.
Хронічні болі будь-якого походження призводять до підвищеної дратівливості, зниження працездатності, втрати інтересу до життя, порушення сну, змін емоційно-вольової сфери, часто доводять до розвитку іпохондрії та депресії. Всі ці наслідки вже самі по собі посилюють патологічну больову реакцію. Виникнення подібної ситуації трактується як утворення замкнутих порочних кіл: больовий подразник – психо-емоційні порушення – поведінкові та мотиваційні порушення, що виявляються у вигляді соціальної, сімейної та особистісної дезадаптації – біль.
Антибольова система (антиноцицептивна) – роль організмі людини. Поріг больової чутливості
 Поряд із існуванням в організмі людини больової системи ( ноцицептивний), існує ще й антибольова система ( антиноцицептивна). Що здійснює антибольова система? Насамперед, для кожного організму існує свій, генетично запрограмований поріг сприйняття больової чутливості. Цей поріг дозволяє пояснити, чому на подразники однакової сили, тривалості та характеру різні людиреагують по-різному. Поняття порога чутливості – це універсальне властивість всіх рецепторних систем організму, зокрема і больових. Так само як і система больової чутливості, антиболева система має складну багаторівневу будову, починаючи з рівня спинного мозку та закінчуючи мозковою корою.
Поряд із існуванням в організмі людини больової системи ( ноцицептивний), існує ще й антибольова система ( антиноцицептивна). Що здійснює антибольова система? Насамперед, для кожного організму існує свій, генетично запрограмований поріг сприйняття больової чутливості. Цей поріг дозволяє пояснити, чому на подразники однакової сили, тривалості та характеру різні людиреагують по-різному. Поняття порога чутливості – це універсальне властивість всіх рецепторних систем організму, зокрема і больових. Так само як і система больової чутливості, антиболева система має складну багаторівневу будову, починаючи з рівня спинного мозку та закінчуючи мозковою корою. Як регулюється діяльність антибольової системи?
Складна діяльність антибольової системи забезпечується ланцюжком складних нейрохімічних та нейрофізіологічних механізмів. Основна роль цій системі належить кільком класам хімічних речовин – мозковим нейропептидам, До них входять і морфиеподобные сполуки – ендогенні опіати(Бета-ендорфін, динорфін, різні енкефаліни). Названі речовини можуть вважатися так званими ендогенними анальгетиками. Зазначені хімічні речовини мають пригнічуючий вплив на нейрони больової системи, активують антибольові нейрони, модулюють активність вищих нервових центрівбольовий чутливості. Зміст даних антибольових речовин у центральній нервовій системі при розвитку больових синдромів зменшується. Очевидно, цим пояснюється зниження порога больової чутливості до появи самостійних больових відчуттів і натомість відсутності больового подразника.Слід також зазначити, що в антибольовій системі поряд з морфієподібними опіатними ендогенними анальгетиками велику роль відіграють і широко відомі мозкові медіатори, такі як: серотонін, норадреналін, дофамін, гамма-аміномасляна кислота (ГАМК), а також гормони та гормоноподібні речовини – вазо гормон), нейротензин. Цікаво, що дія мозкових медіаторів можлива як на рівні спинного, так і головного мозку. Резюмуючи вищесказане, можна зробити висновок, що включення антибольової системи дозволяє послабити потік больової імпульсації і знизити больові відчуття. У разі виникнення будь-яких неточностей у роботі даної системи будь-яка біль то, можливо сприйнято як інтенсивна.
Таким чином, усі болючі відчуття регулюються спільною взаємодією ноцицептивної та антиноцицептивної систем. Тільки їхня узгоджена робота і тонка взаємодія дозволяє адекватно сприймати біль та його інтенсивність, залежно від сили та тривалості впливу подразнюючого фактора.
50757 0
Біль – важлива адаптаційна реакція організму, що має значення сигналу тривоги.
Однак, коли біль стає хронічним, він втрачає своє фізіологічне значення і може вважатися патологією.
Біль є інтегративною функцією організму, що мобілізує різні функціональні системи для захисту від впливу фактора, що ушкоджує. Вона проявляється вегетосоматичними реакціями та характеризується певними психоемоційними змінами.
Термін "біль" має кілька визначень:
- це своєрідний психофізіологічний стан, що виникає внаслідок впливу надсильних або руйнівних подразників, що викликають органічні або функціональні порушення в організмі;
- у вужчому сенсі біль (dolor) - це суб'єктивне тяжке відчуття, що виникає в результаті впливу вказаних надсильних подразників;
- біль - фізіологічний феномен, який інформує нас про шкідливі впливи, що ушкоджують або становлять потенційну небезпеку для організму.
Таким чином, біль – як запобіжна, так і захисна реакція.
Міжнародна Асоціація з вивчення болю дає таке визначення болю (Merskey, Bogduk, 1994):
Біль - неприємне відчуття та емоційне переживання, асоційоване з дійсним та потенційним ушкодженням тканин або стан, що описується словами такого ураження.
Феномен болю не обмежується виключно органічними або функціональними порушеннямив місці її локалізації біль також впливає на діяльність організму як індивідуума. Протягом багатьох років дослідники описували незліченну кількість несприятливих фізіологічних та психологічних наслідків не полегшеного болю.
Фізіологічні наслідки невилікуваного болю будь-якої локалізації можуть включати все, починаючи від погіршення функції шлунково-кишковий тракті дихальної системиі закінчуючи посиленням метаболічних процесів, збільшенням росту пухлин та метастазів, зниженням імунітету та подовженням термінів загоєння, безсонням, збільшенням згортання крові, втратою апетиту та зниженням працездатності.
Психологічні наслідки болю можуть виявлятися у вигляді гніву, дратівливості, почуття страху і тривоги, обурення, занепаду духу, зневіри, депресії, усамітнення, втрати інтересу до життя, зниження здатності до виконання сімейних обов'язків, зниження сексуальної активності, що призводить до сімейних конфліктів і навіть на прохання про евтаназію.
Психологічні та емоційні ефекти часто впливають на суб'єктивну реакцію пацієнта, перебільшення або зменшення значущості болю.
Крім того, певну роль на вираженість психологічних наслідків болю може відігравати ступінь самоконтролю болю та захворювання пацієнтом, ступінь психосоціальної ізоляції, якість соціальної підтримки та, нарешті, знання пацієнтом причин виникнення болю та його наслідків.
Лікарю практично завжди доводиться мати справу з проявами болю-емоціями і больовим поведінкою. Це означає, що ефективність діагностики та лікування визначається не тільки вмінням виявляти етіопатогенетичні механізми соматичного стану, що проявляється або супроводжується болем, а й умінням побачити за цими проявами проблеми обмеження звичного життя пацієнта.
Вивченню причин виникнення та патогенезу болю та больових синдромів присвячено значну кількість робіт, у тому числі і монографій.
Як наукове явище біль вивчають вже понад сто років.
Розрізняють фізіологічний та патологічний біль.
Фізіологічний біль виникає в момент сприйняття відчуттів больовими рецепторами, він характеризується невеликою тривалістю і знаходиться в прямій залежності від сили та тривалості фактора, що ушкоджує. Поведінкова реакція при цьому перериває зв'язок із джерелом ушкодження.
Патологічний біль може виникати як у рецепторах, так і нервових волокнах; вона пов'язана з тривалим загоєнням і є більш руйнівною через потенційну загрозу порушення нормального психологічного та соціального існування індивідуума; поведінкова реакція у своїй - поява тривоги, депресії, пригніченості, що посилює соматическую патологію. Приклади патологічного болю: біль у вогнищі запалення, невропатичний біль, деаферентаційний біль, центральний біль.
Кожен вид патологічного болю має клінічні особливості, які дозволяють розпізнати її причини, механізми та локалізацію.
Типи болю
Виділяють два типи болю.Перший тип- гострий біль, спричинений пошкодженням тканини, що зменшується в міру її загоєння. Гострий біль має раптовий початок, коротку тривалість, чітку локалізацію, що з'являється при дії інтенсивного механічного, термічного або хімічного фактора. Вона може бути викликана інфекцією, пошкодженням або хірургічним втручанням, продовжується протягом декількох годин або днів і часто супроводжується такими ознаками як прискорене серцебиття, пітливість, блідість та безсоння.
Гострим болем (або ноцицептивним) називають біль, який пов'язаний з активацією ноцицепторів після тканинного пошкодження, відповідає ступеню тканинного пошкодження і тривалості дії факторів, що пошкоджують, а потім повністю регресує після загоєння.
Другий тип- хронічний біль розвивається в результаті пошкодження або запалення тканини або нервового волокна, він зберігається або повторюється протягом місяців або навіть років після загоєння, не несе захисної функції і стає причиною страждання пацієнта, вона не супроводжується ознаками, характерними для гострого болю.
Нестерпний хронічний біль має негативний вплив на психологічне, соціальне та духовне життя людини.
При безперервній стимуляції больових рецепторів поріг їх чутливості з часом знижується, і неболючі імпульси теж починають викликати болючі відчуття. Розвиток хронічного болю дослідники пов'язують із невиліковним гострим болем, наголошуючи на необхідності адекватного її лікування.
Невиліковний біль згодом призводить не тільки до матеріального навантаження на пацієнта та його сім'ю, а й тягне за собою величезні витрати суспільства та системи охорони здоров'я, включаючи більш тривалі терміни госпіталізації, зниження працездатності, багаторазове відвідування амбулаторних клінік (поліклінік) та пунктів невідкладної допомоги. Хронічний біль є найчастішою загальнопоширеною причиною тривалої часткової чи повної непрацездатності.
Існує кілька класифікацій болю, одну з них див. 1.
Таблиця 1. Патофізіологічна класифікація хронічного болю
|
1. Артропатії ( ревматоїдний артрит, остеоартрит, подагра, посттравматична артропатія, механічний шийний та спинний синдроми) Невропатичний біль 1. Постгерпетична невралгія Змішаної чи недетермінованої патофізіології 1. Хронічні головні болі, що повторюються (при підвищенні артеріального тиску, мігрень, змішані головні болі) |
Класифікація болю
Запропоновано патогенетичну класифікацію болю (Ліманський, 1986), де вона поділена на соматичну, вісцеральну, нейропатичну та змішану.Соматичний більвиникає при пошкодженні або стимуляції шкіри тіла, а також при пошкодженні глибших структур - м'язів, суглобів та кісток. Кісткові метастази та хірургічні втручанняє звичайними причинами соматичного болю у пацієнтів, які страждають на пухлини. Соматичний біль, як правило, постійний і досить чітко обмежений; вона описується як біль пульсуючий, гризучий і т.д.
Вісцеральний біль
Вісцеральний біль обумовлений розтягуванням, стисненням, запаленням або іншими подразненнями внутрішніх органів.Вона описується як глибока, стискаюча, генералізована і може іррадіювати у шкіру. Вісцеральний біль, як правило, постійний, пацієнту важко встановити її локалізацію. Нейропатичний (або деаферентаційний) біль з'являється при пошкодженні або подразненні нервів.
Вона може бути постійною або нестійкою, іноді стріляє і зазвичай описується як гостра, колюча, ріжуча, пекуча або як неприємне відчуття. Взагалі, нейропатичний біль найсерйозніший порівняно з іншими видами болю, він важче піддається лікуванню.
Клінічно біль
Клінічно біль можна класифікувати так: ноцигенна, нейрогенна, психогенна.Ця класифікація може бути корисною для початкової терапії, однак, надалі подібний поділ неможливий через тісне поєднання цих болів.
Ноцигенний біль
Ноцигенний біль виникає при подразненні шкірних ноцицепторів, ноцицепторів глибоких тканин чи внутрішніх органів. З'являються при цьому імпульси слідують за класичними анатомічними шляхами, досягаючи вищих відділів нервової системи, відображаються свідомістю і формують відчуття болю.Біль при пошкодженні внутрішніх органів є наслідком швидкого скорочення, спазму або розтягування гладких м'язів, оскільки самі гладкі м'язи нечутливі до жару, холоду або розсічення.
Біль від внутрішніх органів, що мають симпатичну іннервацію, може відчуватися у певних зонах на поверхні тіла (зони Захар'їна-Геда) – це відбитий біль. Найбільш відомі приклади такого болю - біль у правому плечі та правій сторонішиї при ураженні жовчного міхура, біль у нижній частині спини при захворюванні сечового міхураі, нарешті, біль у лівій руці та лівій половині грудної клітки при захворюваннях серця. Нейроанатомічна основа цього феномена не зовсім зрозуміла.
Можливе пояснення полягає в тому, що сегментарна іннервація внутрішніх органів та сама, що й віддалених областей поверхні тіла, проте це не пояснює причини відображення болю від органу до поверхні тіла.
Ноцигенний тип болю терапевтично чутливий до морфіну та інших наркотичних анальгетиків.
Нейрогенний біль
Цей тип болю може бути визначений як біль внаслідок пошкодження периферичної або центральної нервової системи і не пояснюється роздратуванням ноцицепторів.Нейрогенний біль має багато клінічних форм.
До них можна віднести деякі ураження периферичної нервової системи, такі як постгерпетична невралгія, діабетична нейропатія, неповне ушкодження периферичного нерва, особливо серединного та ліктьового (рефлекторна симпатична дистрофія), відрив гілок плечового сплетення.
Нейрогенний біль унаслідок ураження центральної нервової системи зазвичай буває обумовлена цереброваскулярною катастрофою - це відомо під класичною назвою "таламічного синдрому", хоча дослідження (Bowsher et al., 1984) показують, що в більшості випадків осередки ураження розташовані в інших областях, ніж таламус.
Багато болю є змішаними та клінічно проявляються ноцигенними та нейрогенними елементами. Наприклад, пухлини викликають і ушкодження тканин та компресію нервів; при діабеті ноцигенний біль виникає внаслідок ураження периферичних судин, а нейрогенний – внаслідок нейропатії; при грижах міжхребцевого диска, що компресують нервовий корінець, больовий синдром включає пекучий і стріляючий нейрогенний елемент.
Психогенний біль
Твердження, що біль може бути виключно психогенного походження, є дискусійним. Широко відомо, що особа пацієнта формує больове відчуття.Воно посилено в істеричних особистостей, і більш точно відбиває реальність у пацієнтів неістероїдного типу. Відомо, що люди різних етнічних груп відрізняються сприйняттям післяопераційного болю.
Пацієнти європейського походження відзначають менш інтенсивний біль, ніж американські негри чи латиноамериканці. Вони також відзначається низька інтенсивність болю проти азіатами, хоча ці відмінності дуже значні (Faucett et al., 1994). Деякі люди стійкіші до розвитку нейрогенного болю. Оскільки ця тенденція має вищезгадані етнічні та культуральні особливості, вона здається вродженою. Тому такі привабливі перспективи досліджень, вкладених у пошук локалізації і виділення " гена болю " (Rappaport, 1996).
Будь-яке хронічне захворювання чи нездужання, що супроводжується болем, впливає на емоції та поведінку особистості.
Біль часто веде до появи тривоги та напруження, які самі збільшують сприйняття болю. Це пояснює важливість психотерапії контролю над болем. Біологічний зворотний зв'язок, релаксаційний тренінг, поведінкова терапія та гіпноз, що застосовуються як психологічне втручання, виявляються корисними в деяких наполегливих, рефрактерних до лікування випадках (Bonica, 1990, Wall, Melzack, 1994, Hart, Alden, 1994).
Лікування буває ефективним, якщо враховує психологічну та ін системи (навколишнє середовище, психофізіологію, поведінкову реакцію), які потенційно впливають на больове сприйняття (Cameron, 1982).
Обговорення психологічного чинника хронічного болю ведеться з урахуванням теорії психоаналізу, з біхевіористських, когнітивних і психофізіологічних позицій (Gamsa, 1994).
Г.І. Лисенка, В.І. Ткаченко